Volgograd, Russian Federation
Volgograd, Volgograd, Russian Federation
Volgograd, Volgograd, Russian Federation
Volgograd, Russian Federation
Volgograd, Russian Federation
from 01.01.2018 until now
Volgograd, Volgograd, Russian Federation
CSCSTI 76.29
Russian Classification of Professions by Education 31.08.73
Russian Library and Bibliographic Classification 566
Russian Trade and Bibliographic Classification 57
Background. The article has explored the problem of the diagnostics of parodontal tissue destruction and revealed the interrelation between the immunoreactivity level and the intensity of resorptive processes. Such biochemical indices as the concentrations of lactate dehydrogenase (LDH) and alkaline phosphatase (ALP) were used as detectors of destructive disease. Polyoxidonium has been suggested as an immunomodulator, as it promotes faster immune and clinical recovery compared to the conventional treatment regimens. Objectives. To estimate the dynamics of destructive pathology indicators (level of LDH and ALP) in paradontium changes, depending on the immunomodulation, added to the combined treatment regimen of elderly patients with periodontitis. Methods. 2 patient cohorts of 67 elderly persons with chronic generalized periodontitis were examined. The conventional treatment was administered in all patient groups. The patients in the second cohort, along with other medications, received Polyoxidonium. The examination included gingival fluid and venous blood sampling, estimation of LDH and ALP concentration as well as evaluation of periodontium indices (papillary-marginal-alveolar index and gingival bleeding index). Results. The study has revealed the rise of LDH and ALP in gingival fluid and venous blood. The recovery trend was observed in both cohorts, with a more marked dynamics in the second one. The mean values of enzyme concentration in the 2-nd group (since the 14th day) were statistically significant compared to the similar measures in the 1st one. After 3 months follow-up the substantial growth of LDH and ALP concentration was registered in the 1st cohort, whereas the 2nd one still showed the recovery trend. Conclusions. The inclusion of immunomodulator Polyoxidonium into the conventional treatment protocol of periodontitis promotes the effectiveness of the therapeutic intervention, discontinues resorptive processes and stabilizes reparative processes in the paradontium.
gerontostomatology, periodontitis, lactate dehydrogenase, alkaline phosphatase, polyoxidonium
Введение
Как известно, пародонтит — это воспалительно-деструктивный процесс, затрагивающий все компоненты пародонтального комплекса. Сутью данного заболевания является деструкция тканей, которая детерминирует формирование пародонтальных карманов. Своеобразным «дирижером» указанных процессов выступает иммунная система, которая в пожилом возрасте функционирует несколько иначе, что, однако, не следует рассматривать как патологию. Это, скорее, возрастная норма, которую в наши дни принято позиционировать как иммуностарение, то есть совокупность всех инволютивных процессов, происходящих в иммунной системе стареющего человека. Иными словами, старость — не болезнь, равно как и иммуностарение — не патология иммунной системы. Но вместе с тем подобные сдвиги в иммунологической реактивности пожилого человека далеко не безразличны для состояния его стоматологического здоровья, а значит, требуют коррекции [1, 4, 8, 22, 25].
Одной из причин ранней потери зубов, по мнению Американской ассоциации стоматологов (ADA), является нарушение удовлетворения потребностей пожилого населения в стоматологическом лечении, что зачастую связано с поздним обращением к профильным специалистам, детерминированной стертой клинической картиной. Действительно, заболевания пародонта у пожилых людей протекают по гипоергическому типу, но на фоне серьезной деструкции поддерживающего зуб аппарата. Подобный клинико-иммунологический тренд создает иллюзию мнимого благополучия, что пагубно сказывается на факторах своевременности и сбалансированности оказания квалифицированной пародонтологической помощи [3, 6, 9, 11].
Следовательно, необходимо внедрение методик ранней диагностики деструктивных процессов пародонтального комплекса даже на фоне слабовыраженного клинического течения пародонтита. Представляется, что оптимальным решением следует считать применение лабораторных методов, в частности, биохимических анализов (наряду с рентгенологическими) [4, 15, 16, 24].
Какие же критерии можно отнести к индикаторам и, возможно, предикторам тканевой деструкции, уровень которых коррелировал бы со степенью выраженности указанного процесса и мог бы использоваться для верификации эффективности того или иного метода терапии?
Как известно, большую роль в патогенезе пародонтита играют ферменты, а точнее повышение их концентрации и активности. Причем наиболее важными следует считать лактатдегидрогеназу (ЛДГ) и щелочную фосфатазу (ЩФ). Источниками указанных энзимов являются клетки самого макроорганизма (в т.ч. иммунокомпетентные, что подтверждает индуцибельный характер повышения уровня ферментов в ответ на провоспалительное состояние), а также компоненты биопленки. Установлено, что рост активности ферментов в десневой жидкости — не только показатель тканевой деструкции, но и фактор, ее инициирующий [7, 14, 23].
К примеру, ЛДГ — это внутриклеточный фермент. Следовательно, повышение его внеклеточной концентрации говорит о гибели клеток, что наблюдается, в частности, при разрушении эпителия прикрепления (при инициации образования истинного кармана), выходе энзима в интерстиций и десневую жидкость. При этом происходит нарушение функциональной активности нейтрофилов (играющих важную роль в местном тканевом ответе) и синтетических процессов в тканях. Замыкается своеобразный порочный круг, усиливающий деструкцию. Именно поэтому повышение активности ЛДГ коррелирует со степенью тяжести пародонтита [17, 23, 24].
Еще одним важным критерием при оценке деструкции пародонтального комплекса является показатель костного метаболизма, в частности, определение уровня ЩФ. Установлено, что данный фермент играет существенную роль в метаболизме костной ткани, причем при выраженной резорбции последней отмечается достоверное повышение активности названного энзима. Главными источниками ЩФ являются остеокласты и нейтрофилы (фермент обнаруживается в лизосомах данных клеток), которые можно отнести к своеобразным «эффекторам» тканевой деструкции при пародонтите [18—21].
Таким образом, уровень ЛДГ и ЩФ напрямую зависит от выраженности воспалительного процесса в пародонтальном комплексе. Значит, повышение концентрации указанных ферментов индуцируется факторами иммунной системы (как клеточными, так и гуморальными) и может быть скорректировано иммуномодулирующей терапией, направленной на гармонизацию иммунологической реактивности, что опосредованно повлияет на резорбтивные процессы, нивелируя тканевую деструкцию [5, 8, 24].
Среди множества видов иммуномодуляции особого внимания заслуживает фармакотерапия препаратом Полиоксидоний. Полиоксидоний (ООО «НПО Петровакс Фарм», Московская область, с. Покров) — истинный иммуномодулятор, обладающий комплексным действием на организм, активирующий неспецифическую резистентность и оказывающий влияние на все компоненты иммунитета, снижая повышенные и повышая пониженные его показатели [2, 8, 13].
Цель исследования — определить динамику показателей тканевой деструкции пародонтального комплекса (уровень ЛДГ и ЩФ) в зависимости от включения этапа иммуномодулирующей терапии в схему комплексного лечения лиц пожилого возраста, страдающих хроническим генерализованным пародонтитом.
Материалы и методы исследования. Под наблюдением находилось 67 человек (39 (58,2 %) женщин и 28 (41,8 %) мужчин) в возрасте от 60 до 74 лет (средний возраст составил 66,3±0,85 года) с верифицированным диагнозом «хронический генерализованный пародонтит средней степени» (К05.3 Хронический пародонтит).
В зависимости от проводимого лечения пациенты были разделены на две клинические группы: 1-ю группу (35 человек) составили лица, которым осуществлялось традиционное лечение хронического генерализованного пародонтита (ХГП), рекомендованное Национальным руководством по пародонтологии; во 2-й группе (32 человека) в схему традиционного лечения ХГП была включена иммуномодулирующая терапия препаратом Полиоксидоний (по 1 табл. (12 мг) сублингвально, 2 раза в день, через 12 часов, ежедневно, в течение 10 дней) [11—13].
Для оценки деструктивных процессов в тканях пародонтального комплекса исследовались десневая жидкость (ее забор осуществлялся по методике, разработанной Чукаевой Н.А.) и венозная кровь (взятая из локтевой вены в количестве 2 мл на пробу), в которых определялась концентрация ферментов ЛДГ и ЩФ.
Уровень ЛДГ определяли с помощью набора реагентов LDH FS (DGKC) фирмы «DiaSys Diagnostic Systems GmbH & Co» (Германия) методом оптимизированного УФ-теста. Для оценки активности ЩФ в работе использовали набор фирмы «Диакон» (Россия), кат. № 10 201, DGKC кинетический, линейность набора до 700 Е/л. Технологию исследования осуществляли в соответствии с паспортом к препарату.
С целью определения тяжести воспалительных процессов в маргинальном пародонте использовались индексы РМА (папиллярно-маргинально-альвеолярный индекс по Parma C., 1960) и ИК (индекс кровоточивости по Мюллеману—Коуэллу, 1975). Клинико-лабораторное обследование проводилось до лечения, на 7-й, 14-й, 21-й, 30-й день, а также через 3 месяца после его начала.
Результаты исследования и их обсуждение. На момент первичного обследования у пациентов обеих групп определялись сопоставимые значения уровня ферментов: ЛДГ в десневой жидкости, ЛДГ и ЩФ в крови (табл. 1, 2).
Таблица 1
Динамика ЛДГ (МЕ/л) в десневой жидкости пациентов в процессе лечения (M±m)
Table 1. Dynamics of gingival fluid LDH (IU/L) in the course of treatment
|
Группа |
Сроки наблюдения |
|||||
|
до лечения |
7-й день |
14-й день |
21-й день |
30-й день |
3-й месяц |
|
|
1 группа |
205,1±1,56 |
199,7±1,8 |
194,6±1,25 * |
190,6±1,63 * |
187,5±2,02 * |
198,1±3,03 |
|
2 группа |
204,4±2,04 |
194,2±2,23 * |
176,4±2,07 * ** |
155,8±4,84 * ** |
145,6±4,94 * ** |
117,9±4,74 * ** |
Примечание: * — достоверность различий со значениями до лечения (p<0,05); ** — достоверность различий между группами (p<0,05).
Таблица 2
Динамика уровня ЛДГ и ЩФ в крови пациентов в процессе лечения (M±m)
Table 2. Dynamics of blood LDH and ALP level in the course of treatment
|
Группа |
Энзим |
Сроки наблюдения |
|||||
|
до лечения |
7-й день |
14-й день |
21-й день |
30-й день |
3-й месяц |
||
|
1 группа (n=35) |
ЛДГ (МЕ/л) |
416,8±3,26 |
416,1±3,17 |
410,4±2,46 |
403,7±2,44 * |
391,2±2,76 * |
413,4±3,07 |
|
ЩФ (МЕ/л) |
217,3±2,18 |
215,4±1,86 |
214,4±1,85 |
211,3±1,6 * |
207,3±1,68 * |
213,3±1,71 |
|
|
2 группа (n=32) |
ЛДГ (МЕ/л) |
415,6±3,03 |
413,6±2,75 |
397,3±2,9 * ** |
377,0±1,63 * ** # |
348,2±1,3 * ** # |
313,6±3,1 * ** # |
|
ЩФ (МЕ/л) |
215,8±2,43 |
206,5±1,8 * ** |
204,2±1,64 * ** |
190,5±1,85 * ** |
183,7±1,65 * ** |
148,6±1,92 * ** |
|
Примечание: * — достоверность различий со значениями до лечения (p<0,05); ** — достоверность различий между группами (p<0,05); # — показатель близок к норме.
Однако уже к 7-му дню наблюдений отмечалась тенденция к снижению концентрации указанных энзимов. Причем во 2-й группе в десневой жидкости средние значения ЛДГ, а в венозной крови — ЩФ оказались достоверно ниже, чем на момент первичного осмотра (p<0,05). Уровень обоих ферментов в названной группе был меньше, чем в 1-й, но статистически достоверной данная разница определялась только в отношении ЩФ (p<0,05). Представляется, что выявленный тренд был связан с проведением этапов профессиональной гигиены полости рта, местной медикаментозной терапии (антибактериальной и противовоспалительной), а также началом хирургического лечения (кюретаж пародонтальных карманов) (рис. 1, 2).
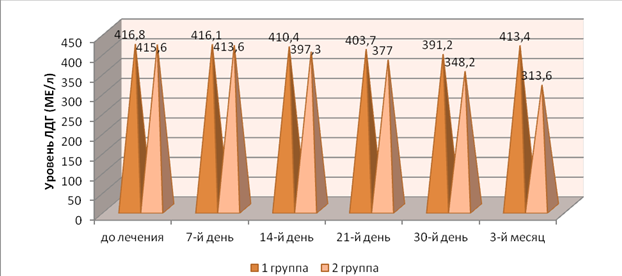
Рис. 1. Динамика уровня ЛДГ в крови в процессе лечения
Fig 1. Dynamics of blood LDH level in the course of treatment
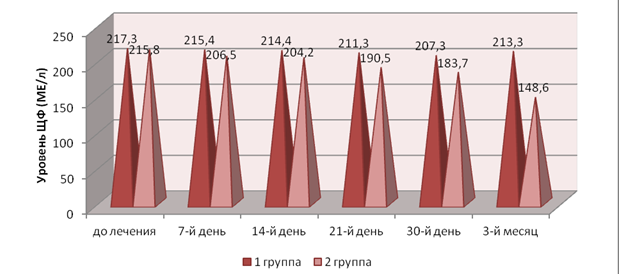
Рис. 2. Динамика уровня ЩФ в крови в процессе лечения
Fig 2. Dynamics of blood ALP level in the course of treatment
На 14-й день наблюдений описанная выше динамика сохранилась: уровень ферментов снижался в обеих группах как в десневой жидкости, так и в крови. Причем в десневой жидкости уменьшение концентрации ЛДГ произошло до уровня, имеющего достоверные различия с данными первичного обследования (p<0,05). Во 2-й группе уровень данного фермента был статистически достоверно ниже, чем в 1-й (p<0,05). В венозной крови снижение средних значений ЛДГ и ЩФ было достоверным (при сравнении с данными первичного обследования) только у пациентов 2-й группы, в которой концентрация названных энзимов, помимо прочего, оказалась достоверно ниже, чем в 1-й. Подобная тенденция связана с окончанием хирургического этапа лечения (кюретаж занимал в среднем около двух недель), элиминацией пародонтопатогеннных факторов (в т.ч. бактериального происхождения), а также «включением» в работу иммуномодулирующего эффекта Полиоксидония (прием которого завершался к 10-му дню) (см. рис. 1, 2).
По истечении трех недель уровень ЛДГ и ЩФ продолжил снижаться как в десневой жидкости, так и в крови. Данное снижение было статистически достоверным (при сопоставлении с результатами, полученными до начала лечения) в обеих группах (p<0,05). В этот период ЛДГ в десневой жидкости, а также ЛДГ и ЩФ в венозной крови пациентов 2-й группы оказались достоверно ниже, чем аналогичные показатели в 1-й (p<0,05). Таким образом, на данном этапе обследования «превосходство» 2-й группы определялось как статистически достоверное, а иммуномодулирующий эффект Полиоксидония мог быть обнаружен в полной мере и считаться верифицированным. Не стоит, однако, исключать и следовой эффект традиционного лечения (связанный с проведением этапов консервативного и хирургического лечения).
Через месяц после начала наблюдений концентрация ферментов продолжила свое снижение в обеих группах. Как и на предыдущем этапе, средние значения ЛДГ и ЩФ в десневой жидкости и венозной крови пациентов 2-й группы были статистически достоверно ниже, чем в 1-й (p<0,05) (см. рис. 1, 2).
Наконец, к 3-му месяцу после начала лечения отмечалась иная картина: в 1-й группе был выявлен рост уровня указанных выше ферментов (как в десневой жидкости, так и в крови) до значений, не имеющих статистически достоверных различий с данными первичного обследования (p>0,05). Во 2-й же группе снижение концентрации ЛДГ и ЩФ продолжилось, а уровень данных энзимов имел достоверные различия с аналогичными показателями в 1-й (p<0,05). Подобная тенденция свидетельствует об окончании следового эффекта традиционного лечения и возобновлении воспалительно-деструктивных процессов в пародонтальном комплексе представителей 1-й группы. В то же время проведенная ранее иммуномодулирующая терапия Полиоксидонием имела более стойкий следовой эффект, чем традиционное лечение, и способствовала сохранению гармонизирующего иммунологические реакции эффекта, выражающегося в противовоспалительном действии.
В процессе клинико-иммунологического обследования было также установлено, что референтные значения концентрации ферментов были выявлены только у ЛДГ (норма: 208—378 МЕ/л) в венозной крови пациентов 2-й группы начиная с 21-го дня наблюдений. Данный факт свидетельствует о приостановлении деструкции эпителиальной и соединительной тканей, что было связано с гармонизацией иммунологической реактивности и, как следствие, нормализацией уровня названного энзима.
В то же время референтных значений концентрации ЩФ в венозной крови (39—117 МЕ/л) не удалось достичь в обеих группах (несмотря на достоверно меньшие значения данного фермента во 2-й группе при сравнении с данными 1-й), что говорит о существенном дисбалансе костного метаболизма в пародонтальном комплексе лиц пожилого возраста и необходимости проведения дальнейших лечебно-профилактических мероприятий. Однако во 2-й группе к 3-му месяцу наблюдений уровень ЛДГ венозной крови лишь на 27 % превосходил референтные значения, в то время как в 1-й – на 168 %. Данный факт свидетельствует о высокой эффективности Полиоксидония в отношении нормализации репаративных процессов в костной ткани, которые имеют первостепенное значение при оценке стоматологического здоровья, а также прогнозе (см. табл. 1, 2).
Стоит отметить, что выявленные выше тенденции в отношении уровня ЛДГ и ЩФ были связаны со степенью тяжести воспалительного процесса в маргинальном пародонте, которая оценивалась с помощью индексов РМА и ИК (табл. 3).
Таблица 3
Динамика клинических показателей в процессе лечения (M±m)
Table 3. Dynamics of clinical indices in the course of treatment
|
Группа |
Индекс |
Сроки наблюдения |
|||||
|
до лечения |
7-й день |
14-й день |
21-й день |
30-й день |
3-й месяц |
||
|
1 группа (n=35) |
РМА |
49,13±1,74
|
23,6±1,18 * |
8,85±0,47 * |
3,35±0,18 * |
3,49±0,33 * |
17,4±0,79 * |
|
ИК |
1,13±0,05
|
0,69±0,04 * |
0,36±0,02 * |
0,21±0,02 * |
0,18±0,02 * |
0,47±0,03 * |
|
|
2 группа (n=32) |
РМА |
49,83±1,37
|
16,7±0,53 * **(1,2) |
4,33±0,21 * **(1,2) |
1,55±0,16 * **(1,2) |
0,91±0,19 * **(1,2) |
7,31±0,54 * **(1,2) |
|
ИК |
1,16±0,06
|
0,54±0,02 * ** |
0,19±0,02 * ** |
0,08±0,015 * ** |
0,08±0,018 * ** |
0,16±0,028 * ** |
|
Примечание: * — достоверность различий со значениями до лечения (p<0,05); ** — достоверность различий между группами (p<0,05).
Клиническое «превосходство» иммуномодуляции верифицировалось с 7-го дня наблюдений и сохранялось на протяжении всех этапов обследования, несмотря на снижение и дальнейшую стабилизацию указанных индексов в 1-й группе (вплоть до 30-го дня) (рис. 3).
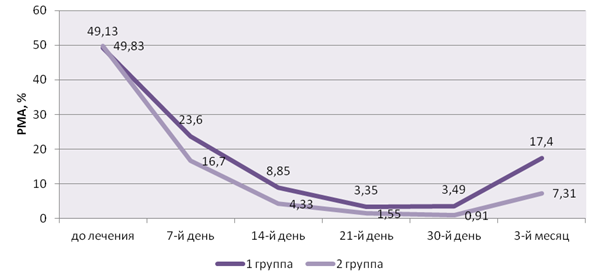
Рис. 3. Динамика индекса PMA в процессе лечения
Fig 3. Dynamics of PMA index in the course of treatment
Отсутствие этапа иммуномодуляции в 1-й группе выражалось в существенном росте названных пародонтологических индексов к 3-му месяцу после начала обследования, что верифицировало возобновление воспалительно-деструктивных процессов в пародонте. Соответственно, росла и концентрация ЛДГ и ЩФ.
Представляется, что между уровнем указанных ферментов и тяжестью воспаления существуют взаимовлияние и взаимообусловленность, управляемые факторами местного и общего иммунитета. Следовательно, при изменении иммунологической реактивности (в частности, при иммуностарении) оправданным является назначение иммуномодулирующей терапии, гармонизирующей последнюю и опосредованно нормализующей репаративные процессы в поддерживающем зуб аппарате, что нивелирует тканевую деструкцию (рис. 4).
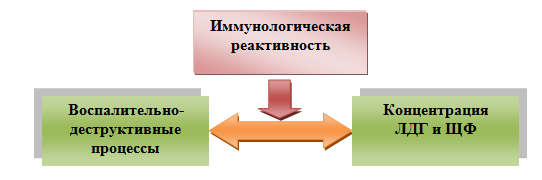
Рис. 4. Схема взаимосвязи воспалительно-деструктивных процессов с уровнем ферментов
Fig 4. Diagram of the relationship between inflammatory-destructive diseases and enzyme activity
Уровень самих ферментов (ЛДГ и ЩФ) целесообразно рассматривать как индикаторы и (что более важно) предикторы тканевой деструкции пародонтального комплекса. Динамика концентрации указанных энзимов ассоциирована с тяжестью воспалительно-деструктивных процессов и может быть использована при оценке эффективности проводимого лечения, в том числе иммуномодулирующего.
Выводы. Таким образом, гармонизация иммунологической реактивности, способствующая более эффективной элиминации пародонтопатогенов и выражающаяся в стойком снижении уровня воспаления в пародонтальном комплексе, сказывается на концентрации ЛДГ и ЩФ, отражающей степень тканевой деструкции. Следовательно, иммуномодулирующую терапию стоит рассматривать как важный этап комплексного лечения пародонтита у лиц старших возрастных групп, позволяющий приостановить резорбтивные и стабилизировать репаративные процессы в поддерживающем зуб аппарате, улучшить прогноз и тем самым повысить их качество жизни.
1. Vol'f G.F., Ratejchak J.M., Ratejchak K. ed. Barera G.M. Parodontologija [Periodontology]. Moscow, MEDpress-inform, 2008, 548 p.
2. Grudjanov A.I. Zabolevanija parodonta [Periodontal diseases]. Moscow, Izd-vo «Med. inform. agentstvo», 2009, 336 p.
3. Zhura V.V., Rudova Yu.V. [Corporeal culture as an indication of medicalization of the community and its representation in the medical discourse]. Gumanitarnye i social'nye nauki = Humanities and social sciences, 2014, no. 2, pp. 551-554. (In Russ.)
4. Isamulaeva A.Z., Kunin A.A., Spicyna A.V., Sergienko D.F., Isamulaeva A.I. [Clinical and immunological potency evaluation of Interleukinum-1β in gel form applicated on the paradontium-injured patients]. Parodontologiya = Periodontology, 2014, no. 4 (73), pp. 63-67. (In Russ.)
5. Isamulaeva A.Z., Kunin A.A. [Modern aspects of predictable methods in diagnostics and profilaxes of paradontosis]. Astrahanskij medicinskij zhurnal = Astrakhan Medical Journal, 2013, vol. 8, no. 1, pp. 108-111. (In Russ.)
6. Kakulija I.S. [Some characteristics of course of periodontal diseases in elderly patients]. Medicinskaja sestra = Sick nurse, 2008, no. 5, pp. 10-11. (In Russ.)
7. Vasiliadis R.A., Belskaya N.A., Vayner G.B., Denisova S.G., Borodulin V.B. [Clinical and diagnostic evaluation of oral fluid enzymes in patients with varying severity of periodontitis]. Fundamental'nye issledovaniya = Fundamental research, 2014, no. 10(6), pp. 1056-1061. (In Russ.)
8. Krajnov S.V., Mihal'chenko V.F., Popova A.N., Jakovlev A.T., Linchenko I.V. [The influence of immunomodulation on crevicular fluids cell composition of elderly patients with periodontitis]. Problemy stomatologii = Actual problems in dentistry, 2018, vol. 14, no. 1, pp. 21-25. (In Russ.)
9. Krajnov S.V., Mihal'chenko V.F., Jakovlev A.T., Popova A.N., Alehanova I.F. [Depth of the periodontal pockets or «attachment loss», which parameter to select in gerontostomatology?]. Problemy stomatologii = Actual problems in dentistry, 2017, vol. 13, no. 4, pp. 9-14. (In Russ.)
10. Kuznecov S.V., ed. Kulakov A.A. Klinicheskaja gerontostomatologija [Clinical gerontostomatology]. Moscow, OOO «Med. inform. agentstvo», 2013, 240 p.
11. Iordanishvili A.K. et al. Lechenie parodontita v pozhilom i starcheskom vozraste [Treating of periodontitis in elderly patients]. SPb, MANJeB-Nordmedizdat, 2011, 128 p.
12. Ed. Dmitrievoj L.A. Parodontologija: nacional'noe rukovodstvo [Periodontology: The National guidebook]. Moscow, GJeOTAR-Media, 2014, 704 p.
13. Pinegin B.V., Nekrasov A.V., Haitov R.M. [Immunomodulator polyoxidonium: mechanisms of action and aspects of clinical application]. Citokiny i vospalenie = Cytokines & inflammation, 2004, vol. 3, no. 3, pp. 41-47. (In Russ.)
14. Cybikov N.N. et al. [The properties of the gingival fluid from the patients presenting with acute gingivitis and chronic periodontitis]. Ros. stomat. Zhurnal = Russian Journal of Dentistry, 2012, no. 1, pp. 40-42. (In Russ.)
15. Iordanishvili A.K. et al. [The stomatologic status of people of elderly and senile age]. Uspehi gerontologii = Advances in Gerontology, 2010, vol. 23, no. 4, pp. 644-651. (In Russ.)
16. Cepov L.M. Zabolevanija parodonta: vzgljad na problem [Periodontal diseases: look at an issue]. Moscow, MEDpress-inform, 2006, 192 p.
17. Yarova S.P., Voropaeva A.A., Bessmertniy A.A. [Activity of enzymes in mouth liquid at patient with chronic periodontitis]. Sovremennaya stomatologiya = Modern dentistry, 2009, no. 2, pp. 34-36. (In Russ.)
18. Malhotra R. et al. Alkaline phosphatase as a periodontal disease marker. Indian Journal of Dental Research, 2010, vol. 21, no. 4, pp. 531-536.
19. Gibert P., Tramini .P., Sieso V. Alkaline phosphatase isozyme activity in serum from patients with chronic periodontitis. J. Periodontal Res, 2003, vol. 38, no. 4, pp. 362-365.
20. Perinetti G. et al. Gingival crevicular fluid alkaline phosphatase activity as a non-invasive biomarker of skeletal maturation. Orthodontics & Craniofacial Res, 2011, vol. 14, no. 1, pp. 44-50.
21. Daltaban O. et al. Gingival crevicular fluid alkaline phosphatase levels in postmenopausal women: effects of phase I periodontal treatment. J. Periodontol., 2006, vol. 77, no. 1, pp. 67-72.
22. Miller R. Aging and immune function. Fundamental Immunology, 4th ed, ed. Paul W.E., Philadelphia, Lippincott-Raven Publ, 1999, pp. 974-965.
23. Todorovic T. et al. Salivary enzymes and periodontal. Med. Oral Patol. Oral Cir. Bucal, 2006, vol. 1, no. 11(2), pp. 115-119.
24. Nomura Y. et al. Screening of periodontitis with salivary enzyme tests. J. Oral. Sci., 2006, vol. 48, no. 4, pp. 177-183.
25. United Nations. Problems of the elderly and the agrd. Draft programme andarrangements for the World Assembly on the Elderly: report of the Secretary General. New York, 2011, pp. 72.
26. Zhura V.V., Rudova Yu.V. Bioethical aspects of medical discourse. Bioethics, 2016, no. 1 (17), pp. 42-46.




















