Волгоградская область, Россия
Волгоград, Волгоградская область, Россия
Волгоград, Волгоградская область, Россия
Волгоградская область, Россия
Волгоградская область, Россия
с 01.01.2018 по настоящее время
Волгоград, Волгоградская область, Россия
ГРНТИ 76.29 Клиническая медицина
ОКСО 31.08.73 Стоматология терапевтическая
ББК 566 Стоматология
ТБК 57 Медицина. Фармакология
Предмет. В статье рассмотрены проблема диагностики деструкции пародонта, а также взаимосвязь уровня иммунологической реактивности и выраженности резорбции тканей. Показатели концентрации ферментов лактатдегидрогеназы (ЛДГ) и щелочной фосфатазы (ЩФ) были использованы как индикаторы деструктивных процессов. В качестве иммуномодулятора авторы предлагают Полиоксидоний, способствующий гармонизации иммунитета и более скорой нормализации клинических показателей в сравнении с традиционным лечением. Цель — определить динамику показателей тканевой деструкции пародонтального комплекса (уровень ферментов ЛДГ и ЩФ) в зависимости от включения этапа иммуномодулирующей терапии в схему комплексного лечения лиц пожилого возраста, страдающих хроническим генерализованным пародонтитом. Методология. Были обследованы две клинические группы (67 человек) лиц пожилого возраста с диагнозом «хронический генерализованный пародонтит средней степени». Всем пациентам проводилась однотипная базовая терапия. Во 2-й группе также назначался иммуномодулятор Полиоксидоний. Обследование включало сбор десневой жидкости и венозной крови, определение в них концентрации ЛДГ и ЩФ, а также индексную оценку (папиллярно-маргинально-альвеолярный индекс, индекс кровоточивости). Результаты. Проведенное исследование выявило существенное повышение уровня ферментов ЛДГ и ЩФ в десневой жидкости и венозной крови. В процессе лечения у всех пациентов отмечалась тенденция к снижению данных биохимических показателей, причем во 2-й группе указанная динамика была более выражена, а средние значения концентрации ЛДГ и ЩФ в течение всего периода обследования (начиная с 14-го дня) достоверно отличались от таковых в 1-й. Через 3 месяца после начала наблюдений был выявлен существенный рост уровня ферментов в 1-й группе, в то время как во 2-й тенденция к снижению их концентрации сохранилась. Выводы. Включение в схему лечения пародонтита этапа иммуномодуляции препаратом Полиоксидоний позволяет повысить эффективность терапевтических мероприятий, приостановить резорбтивные и стабилизировать репаративные процессы в поддерживающем зуб аппарате.
геронтостоматология, пародонтит, лактатдегидрогеназа, щелочная фосфатаза, Полиоксидоний
Введение
Как известно, пародонтит — это воспалительно-деструктивный процесс, затрагивающий все компоненты пародонтального комплекса. Сутью данного заболевания является деструкция тканей, которая детерминирует формирование пародонтальных карманов. Своеобразным «дирижером» указанных процессов выступает иммунная система, которая в пожилом возрасте функционирует несколько иначе, что, однако, не следует рассматривать как патологию. Это, скорее, возрастная норма, которую в наши дни принято позиционировать как иммуностарение, то есть совокупность всех инволютивных процессов, происходящих в иммунной системе стареющего человека. Иными словами, старость — не болезнь, равно как и иммуностарение — не патология иммунной системы. Но вместе с тем подобные сдвиги в иммунологической реактивности пожилого человека далеко не безразличны для состояния его стоматологического здоровья, а значит, требуют коррекции [1, 4, 8, 22, 25].
Одной из причин ранней потери зубов, по мнению Американской ассоциации стоматологов (ADA), является нарушение удовлетворения потребностей пожилого населения в стоматологическом лечении, что зачастую связано с поздним обращением к профильным специалистам, детерминированной стертой клинической картиной. Действительно, заболевания пародонта у пожилых людей протекают по гипоергическому типу, но на фоне серьезной деструкции поддерживающего зуб аппарата. Подобный клинико-иммунологический тренд создает иллюзию мнимого благополучия, что пагубно сказывается на факторах своевременности и сбалансированности оказания квалифицированной пародонтологической помощи [3, 6, 9, 11].
Следовательно, необходимо внедрение методик ранней диагностики деструктивных процессов пародонтального комплекса даже на фоне слабовыраженного клинического течения пародонтита. Представляется, что оптимальным решением следует считать применение лабораторных методов, в частности, биохимических анализов (наряду с рентгенологическими) [4, 15, 16, 24].
Какие же критерии можно отнести к индикаторам и, возможно, предикторам тканевой деструкции, уровень которых коррелировал бы со степенью выраженности указанного процесса и мог бы использоваться для верификации эффективности того или иного метода терапии?
Как известно, большую роль в патогенезе пародонтита играют ферменты, а точнее повышение их концентрации и активности. Причем наиболее важными следует считать лактатдегидрогеназу (ЛДГ) и щелочную фосфатазу (ЩФ). Источниками указанных энзимов являются клетки самого макроорганизма (в т.ч. иммунокомпетентные, что подтверждает индуцибельный характер повышения уровня ферментов в ответ на провоспалительное состояние), а также компоненты биопленки. Установлено, что рост активности ферментов в десневой жидкости — не только показатель тканевой деструкции, но и фактор, ее инициирующий [7, 14, 23].
К примеру, ЛДГ — это внутриклеточный фермент. Следовательно, повышение его внеклеточной концентрации говорит о гибели клеток, что наблюдается, в частности, при разрушении эпителия прикрепления (при инициации образования истинного кармана), выходе энзима в интерстиций и десневую жидкость. При этом происходит нарушение функциональной активности нейтрофилов (играющих важную роль в местном тканевом ответе) и синтетических процессов в тканях. Замыкается своеобразный порочный круг, усиливающий деструкцию. Именно поэтому повышение активности ЛДГ коррелирует со степенью тяжести пародонтита [17, 23, 24].
Еще одним важным критерием при оценке деструкции пародонтального комплекса является показатель костного метаболизма, в частности, определение уровня ЩФ. Установлено, что данный фермент играет существенную роль в метаболизме костной ткани, причем при выраженной резорбции последней отмечается достоверное повышение активности названного энзима. Главными источниками ЩФ являются остеокласты и нейтрофилы (фермент обнаруживается в лизосомах данных клеток), которые можно отнести к своеобразным «эффекторам» тканевой деструкции при пародонтите [18—21].
Таким образом, уровень ЛДГ и ЩФ напрямую зависит от выраженности воспалительного процесса в пародонтальном комплексе. Значит, повышение концентрации указанных ферментов индуцируется факторами иммунной системы (как клеточными, так и гуморальными) и может быть скорректировано иммуномодулирующей терапией, направленной на гармонизацию иммунологической реактивности, что опосредованно повлияет на резорбтивные процессы, нивелируя тканевую деструкцию [5, 8, 24].
Среди множества видов иммуномодуляции особого внимания заслуживает фармакотерапия препаратом Полиоксидоний. Полиоксидоний (ООО «НПО Петровакс Фарм», Московская область, с. Покров) — истинный иммуномодулятор, обладающий комплексным действием на организм, активирующий неспецифическую резистентность и оказывающий влияние на все компоненты иммунитета, снижая повышенные и повышая пониженные его показатели [2, 8, 13].
Цель исследования — определить динамику показателей тканевой деструкции пародонтального комплекса (уровень ЛДГ и ЩФ) в зависимости от включения этапа иммуномодулирующей терапии в схему комплексного лечения лиц пожилого возраста, страдающих хроническим генерализованным пародонтитом.
Материалы и методы исследования. Под наблюдением находилось 67 человек (39 (58,2 %) женщин и 28 (41,8 %) мужчин) в возрасте от 60 до 74 лет (средний возраст составил 66,3±0,85 года) с верифицированным диагнозом «хронический генерализованный пародонтит средней степени» (К05.3 Хронический пародонтит).
В зависимости от проводимого лечения пациенты были разделены на две клинические группы: 1-ю группу (35 человек) составили лица, которым осуществлялось традиционное лечение хронического генерализованного пародонтита (ХГП), рекомендованное Национальным руководством по пародонтологии; во 2-й группе (32 человека) в схему традиционного лечения ХГП была включена иммуномодулирующая терапия препаратом Полиоксидоний (по 1 табл. (12 мг) сублингвально, 2 раза в день, через 12 часов, ежедневно, в течение 10 дней) [11—13].
Для оценки деструктивных процессов в тканях пародонтального комплекса исследовались десневая жидкость (ее забор осуществлялся по методике, разработанной Чукаевой Н.А.) и венозная кровь (взятая из локтевой вены в количестве 2 мл на пробу), в которых определялась концентрация ферментов ЛДГ и ЩФ.
Уровень ЛДГ определяли с помощью набора реагентов LDH FS (DGKC) фирмы «DiaSys Diagnostic Systems GmbH & Co» (Германия) методом оптимизированного УФ-теста. Для оценки активности ЩФ в работе использовали набор фирмы «Диакон» (Россия), кат. № 10 201, DGKC кинетический, линейность набора до 700 Е/л. Технологию исследования осуществляли в соответствии с паспортом к препарату.
С целью определения тяжести воспалительных процессов в маргинальном пародонте использовались индексы РМА (папиллярно-маргинально-альвеолярный индекс по Parma C., 1960) и ИК (индекс кровоточивости по Мюллеману—Коуэллу, 1975). Клинико-лабораторное обследование проводилось до лечения, на 7-й, 14-й, 21-й, 30-й день, а также через 3 месяца после его начала.
Результаты исследования и их обсуждение. На момент первичного обследования у пациентов обеих групп определялись сопоставимые значения уровня ферментов: ЛДГ в десневой жидкости, ЛДГ и ЩФ в крови (табл. 1, 2).
Таблица 1
Динамика ЛДГ (МЕ/л) в десневой жидкости пациентов в процессе лечения (M±m)
Table 1. Dynamics of gingival fluid LDH (IU/L) in the course of treatment
|
Группа |
Сроки наблюдения |
|||||
|
до лечения |
7-й день |
14-й день |
21-й день |
30-й день |
3-й месяц |
|
|
1 группа |
205,1±1,56 |
199,7±1,8 |
194,6±1,25 * |
190,6±1,63 * |
187,5±2,02 * |
198,1±3,03 |
|
2 группа |
204,4±2,04 |
194,2±2,23 * |
176,4±2,07 * ** |
155,8±4,84 * ** |
145,6±4,94 * ** |
117,9±4,74 * ** |
Примечание: * — достоверность различий со значениями до лечения (p<0,05); ** — достоверность различий между группами (p<0,05).
Таблица 2
Динамика уровня ЛДГ и ЩФ в крови пациентов в процессе лечения (M±m)
Table 2. Dynamics of blood LDH and ALP level in the course of treatment
|
Группа |
Энзим |
Сроки наблюдения |
|||||
|
до лечения |
7-й день |
14-й день |
21-й день |
30-й день |
3-й месяц |
||
|
1 группа (n=35) |
ЛДГ (МЕ/л) |
416,8±3,26 |
416,1±3,17 |
410,4±2,46 |
403,7±2,44 * |
391,2±2,76 * |
413,4±3,07 |
|
ЩФ (МЕ/л) |
217,3±2,18 |
215,4±1,86 |
214,4±1,85 |
211,3±1,6 * |
207,3±1,68 * |
213,3±1,71 |
|
|
2 группа (n=32) |
ЛДГ (МЕ/л) |
415,6±3,03 |
413,6±2,75 |
397,3±2,9 * ** |
377,0±1,63 * ** # |
348,2±1,3 * ** # |
313,6±3,1 * ** # |
|
ЩФ (МЕ/л) |
215,8±2,43 |
206,5±1,8 * ** |
204,2±1,64 * ** |
190,5±1,85 * ** |
183,7±1,65 * ** |
148,6±1,92 * ** |
|
Примечание: * — достоверность различий со значениями до лечения (p<0,05); ** — достоверность различий между группами (p<0,05); # — показатель близок к норме.
Однако уже к 7-му дню наблюдений отмечалась тенденция к снижению концентрации указанных энзимов. Причем во 2-й группе в десневой жидкости средние значения ЛДГ, а в венозной крови — ЩФ оказались достоверно ниже, чем на момент первичного осмотра (p<0,05). Уровень обоих ферментов в названной группе был меньше, чем в 1-й, но статистически достоверной данная разница определялась только в отношении ЩФ (p<0,05). Представляется, что выявленный тренд был связан с проведением этапов профессиональной гигиены полости рта, местной медикаментозной терапии (антибактериальной и противовоспалительной), а также началом хирургического лечения (кюретаж пародонтальных карманов) (рис. 1, 2).
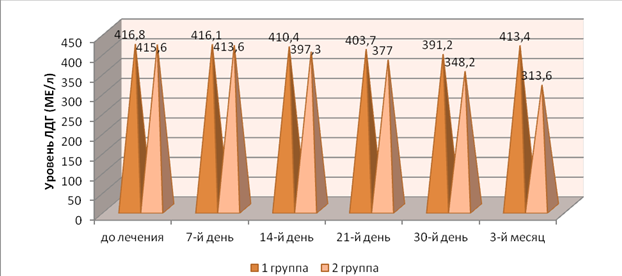
Рис. 1. Динамика уровня ЛДГ в крови в процессе лечения
Fig 1. Dynamics of blood LDH level in the course of treatment
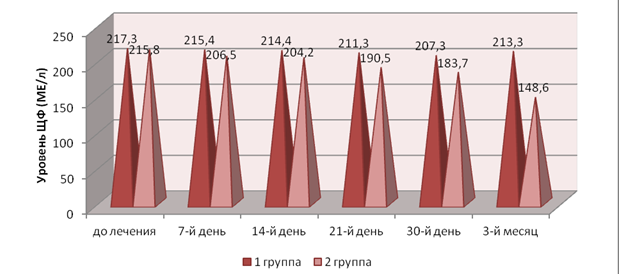
Рис. 2. Динамика уровня ЩФ в крови в процессе лечения
Fig 2. Dynamics of blood ALP level in the course of treatment
На 14-й день наблюдений описанная выше динамика сохранилась: уровень ферментов снижался в обеих группах как в десневой жидкости, так и в крови. Причем в десневой жидкости уменьшение концентрации ЛДГ произошло до уровня, имеющего достоверные различия с данными первичного обследования (p<0,05). Во 2-й группе уровень данного фермента был статистически достоверно ниже, чем в 1-й (p<0,05). В венозной крови снижение средних значений ЛДГ и ЩФ было достоверным (при сравнении с данными первичного обследования) только у пациентов 2-й группы, в которой концентрация названных энзимов, помимо прочего, оказалась достоверно ниже, чем в 1-й. Подобная тенденция связана с окончанием хирургического этапа лечения (кюретаж занимал в среднем около двух недель), элиминацией пародонтопатогеннных факторов (в т.ч. бактериального происхождения), а также «включением» в работу иммуномодулирующего эффекта Полиоксидония (прием которого завершался к 10-му дню) (см. рис. 1, 2).
По истечении трех недель уровень ЛДГ и ЩФ продолжил снижаться как в десневой жидкости, так и в крови. Данное снижение было статистически достоверным (при сопоставлении с результатами, полученными до начала лечения) в обеих группах (p<0,05). В этот период ЛДГ в десневой жидкости, а также ЛДГ и ЩФ в венозной крови пациентов 2-й группы оказались достоверно ниже, чем аналогичные показатели в 1-й (p<0,05). Таким образом, на данном этапе обследования «превосходство» 2-й группы определялось как статистически достоверное, а иммуномодулирующий эффект Полиоксидония мог быть обнаружен в полной мере и считаться верифицированным. Не стоит, однако, исключать и следовой эффект традиционного лечения (связанный с проведением этапов консервативного и хирургического лечения).
Через месяц после начала наблюдений концентрация ферментов продолжила свое снижение в обеих группах. Как и на предыдущем этапе, средние значения ЛДГ и ЩФ в десневой жидкости и венозной крови пациентов 2-й группы были статистически достоверно ниже, чем в 1-й (p<0,05) (см. рис. 1, 2).
Наконец, к 3-му месяцу после начала лечения отмечалась иная картина: в 1-й группе был выявлен рост уровня указанных выше ферментов (как в десневой жидкости, так и в крови) до значений, не имеющих статистически достоверных различий с данными первичного обследования (p>0,05). Во 2-й же группе снижение концентрации ЛДГ и ЩФ продолжилось, а уровень данных энзимов имел достоверные различия с аналогичными показателями в 1-й (p<0,05). Подобная тенденция свидетельствует об окончании следового эффекта традиционного лечения и возобновлении воспалительно-деструктивных процессов в пародонтальном комплексе представителей 1-й группы. В то же время проведенная ранее иммуномодулирующая терапия Полиоксидонием имела более стойкий следовой эффект, чем традиционное лечение, и способствовала сохранению гармонизирующего иммунологические реакции эффекта, выражающегося в противовоспалительном действии.
В процессе клинико-иммунологического обследования было также установлено, что референтные значения концентрации ферментов были выявлены только у ЛДГ (норма: 208—378 МЕ/л) в венозной крови пациентов 2-й группы начиная с 21-го дня наблюдений. Данный факт свидетельствует о приостановлении деструкции эпителиальной и соединительной тканей, что было связано с гармонизацией иммунологической реактивности и, как следствие, нормализацией уровня названного энзима.
В то же время референтных значений концентрации ЩФ в венозной крови (39—117 МЕ/л) не удалось достичь в обеих группах (несмотря на достоверно меньшие значения данного фермента во 2-й группе при сравнении с данными 1-й), что говорит о существенном дисбалансе костного метаболизма в пародонтальном комплексе лиц пожилого возраста и необходимости проведения дальнейших лечебно-профилактических мероприятий. Однако во 2-й группе к 3-му месяцу наблюдений уровень ЛДГ венозной крови лишь на 27 % превосходил референтные значения, в то время как в 1-й – на 168 %. Данный факт свидетельствует о высокой эффективности Полиоксидония в отношении нормализации репаративных процессов в костной ткани, которые имеют первостепенное значение при оценке стоматологического здоровья, а также прогнозе (см. табл. 1, 2).
Стоит отметить, что выявленные выше тенденции в отношении уровня ЛДГ и ЩФ были связаны со степенью тяжести воспалительного процесса в маргинальном пародонте, которая оценивалась с помощью индексов РМА и ИК (табл. 3).
Таблица 3
Динамика клинических показателей в процессе лечения (M±m)
Table 3. Dynamics of clinical indices in the course of treatment
|
Группа |
Индекс |
Сроки наблюдения |
|||||
|
до лечения |
7-й день |
14-й день |
21-й день |
30-й день |
3-й месяц |
||
|
1 группа (n=35) |
РМА |
49,13±1,74
|
23,6±1,18 * |
8,85±0,47 * |
3,35±0,18 * |
3,49±0,33 * |
17,4±0,79 * |
|
ИК |
1,13±0,05
|
0,69±0,04 * |
0,36±0,02 * |
0,21±0,02 * |
0,18±0,02 * |
0,47±0,03 * |
|
|
2 группа (n=32) |
РМА |
49,83±1,37
|
16,7±0,53 * **(1,2) |
4,33±0,21 * **(1,2) |
1,55±0,16 * **(1,2) |
0,91±0,19 * **(1,2) |
7,31±0,54 * **(1,2) |
|
ИК |
1,16±0,06
|
0,54±0,02 * ** |
0,19±0,02 * ** |
0,08±0,015 * ** |
0,08±0,018 * ** |
0,16±0,028 * ** |
|
Примечание: * — достоверность различий со значениями до лечения (p<0,05); ** — достоверность различий между группами (p<0,05).
Клиническое «превосходство» иммуномодуляции верифицировалось с 7-го дня наблюдений и сохранялось на протяжении всех этапов обследования, несмотря на снижение и дальнейшую стабилизацию указанных индексов в 1-й группе (вплоть до 30-го дня) (рис. 3).
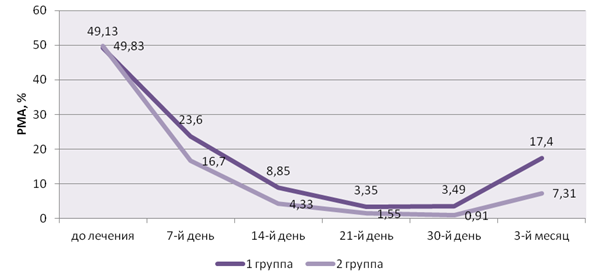
Рис. 3. Динамика индекса PMA в процессе лечения
Fig 3. Dynamics of PMA index in the course of treatment
Отсутствие этапа иммуномодуляции в 1-й группе выражалось в существенном росте названных пародонтологических индексов к 3-му месяцу после начала обследования, что верифицировало возобновление воспалительно-деструктивных процессов в пародонте. Соответственно, росла и концентрация ЛДГ и ЩФ.
Представляется, что между уровнем указанных ферментов и тяжестью воспаления существуют взаимовлияние и взаимообусловленность, управляемые факторами местного и общего иммунитета. Следовательно, при изменении иммунологической реактивности (в частности, при иммуностарении) оправданным является назначение иммуномодулирующей терапии, гармонизирующей последнюю и опосредованно нормализующей репаративные процессы в поддерживающем зуб аппарате, что нивелирует тканевую деструкцию (рис. 4).
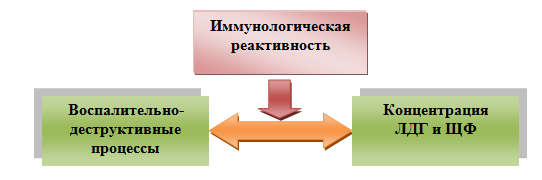
Рис. 4. Схема взаимосвязи воспалительно-деструктивных процессов с уровнем ферментов
Fig 4. Diagram of the relationship between inflammatory-destructive diseases and enzyme activity
Уровень самих ферментов (ЛДГ и ЩФ) целесообразно рассматривать как индикаторы и (что более важно) предикторы тканевой деструкции пародонтального комплекса. Динамика концентрации указанных энзимов ассоциирована с тяжестью воспалительно-деструктивных процессов и может быть использована при оценке эффективности проводимого лечения, в том числе иммуномодулирующего.
Выводы. Таким образом, гармонизация иммунологической реактивности, способствующая более эффективной элиминации пародонтопатогенов и выражающаяся в стойком снижении уровня воспаления в пародонтальном комплексе, сказывается на концентрации ЛДГ и ЩФ, отражающей степень тканевой деструкции. Следовательно, иммуномодулирующую терапию стоит рассматривать как важный этап комплексного лечения пародонтита у лиц старших возрастных групп, позволяющий приостановить резорбтивные и стабилизировать репаративные процессы в поддерживающем зуб аппарате, улучшить прогноз и тем самым повысить их качество жизни.
1. Вольф, Г. Ф. Пародонтология / Г. Ф. Вольф, Э. М. Ратейцхак, К. Ратейцхак ; пер. с нем. ; под ред. проф. Г. М. Барера. - Москва : МЕДпресс-информ, 2008. - 548 с.
2. Грудянов, А. И. Заболевания пародонта / А. И. Грудянов. - Москва : Изд-во «Мед. информ. агентство», 2009. - 336 с.
3. Жура, В. В. Корпореальная культура как отражение процесса медикализации общества и ее репрезентация в медицинском дискурсе / В. В. Жура, Ю. В. Рудова // Гуманитарные и социальные науки. - 2014. - № 2. - С. 551-554.
4. Исамулаева, А. З. Современные аспекты предупредительных методов диагностики и профилактики заболеваний пародонта / А. З. Исамулаева, А. А. Кунин // Астраханский медицинский журнал. - 2013. - Т. 8, № 1. - С. 108-111.
5. Клинико-иммунологическая оценка эффективности применения интерлейкин-1β в гелевой форме у больных с поражением пародонта / А. З. Исамулаева, А. А. Кунин, А. В. Спицына, Д. Ф. Сергиенко, А. И. Исамулаева // Пародонтология. - 2014. - № 4 (73). - С. 63-67.
6. Какулия, И. С. Особенности течения пародонтита в пожилом возрасте / И. С. Какулия // Медицинская сестра. - 2008. - № 5. - С. 10-11.
7. Клинико-диагностическая оценка ферментов ротовой жидкости у больных с пародонтитами различной степени тяжести / Р. А. Василиадис [и др.] // Фундаментальные исследования. - 2014. - № 10 (6). - С. 1056-1061.
8. Влияние иммуномодулирующей терапии на клеточный состав десневой жидкости у лиц пожилого возраста, страдающих пародонтитом / С. В. Крайнов, В. Ф. Михальченко, А. Н. Попова, А. Т. Яковлев, И. В. Линченко // Проблемы стоматологии. - 2018. - Т. 14, № 1. - С. 21-25.
9. «Глубина пародонтального кармана» или «величина потери прикрепления», какой параметр выбрать в геронтостоматологии? / С. В. Крайнов, В. Ф. Михальченко, А. Т. Яковлев, А. Н. Попова, И. Ф. Алеханова // Проблемы стоматологии. - 2017. - Т. 13, № 4. - С. 9-14.
10. Кузнецов, С. В. Клиническая геронтостоматология / С. В. Кузнецов ; под ред. д-ра мед. наук, проф. А. А. Кулакова. - Москва : ООО «Мед. информ. агентство», 2013. - 240 с.
11. Лечение пародонтита в пожилом и старческом возрасте / А. К. Иорданишвили [и др.] - Санкт-Петербург : МАНЭБ-Нордмедиздат, 2011. - 128 с.
12. Пародонтология : национальное руководство / под ред. проф. Л. А. Дмитриевой. - Москва : ГЭОТАР-Медиа, 2014. - 704 с.
13. Пинегин, Б. В. Иммуномодулятор Полиоксидоний: механизмы действия и аспекты клинического применения / Б. В. Пинегин, А. В. Некрасов, Р. М. Хаитов // Цитокины и воспаление. - 2004. - Т. 3, № 3. - С. 41-47.
14. Свойства десневой жидкости при остром гингивите и хроническом пародонтите / Н. Н. Цыбиков [и др.] // Рос. стомат. журнал. - 2012. - № 1. - С. 40-42.
15. Стоматологический статус людей пожилого и старческого возраста / А. К. Иорданишвили [и др.] // Успехи геронтологии. - 2010. - Т. 23, № 4. - С. 644-651.
16. Цепов, Л. М. Заболевания пародонта: взгляд на проблему / Л. М. Цепов - Москва : МЕДпресс-информ, 2006. - 192 с.
17. Ярова, С. П. Активность ферментов в ротовой жидкости больных хроническим пародонтитом / С. П. Ярова, А. А. Воропаева, А. А. Бессмертный // Современная стоматология. - 2009. - № 2. - С. 34-36.
18. Malhotra R. et al. Alkaline phosphatase as a periodontal disease marker. Indian Journal of Dental Research, 2010, vol. 21, no. 4, pp. 531-536.
19. Gibert P., Tramini .P., Sieso V. Alkaline phosphatase isozyme activity in serum from patients with chronic periodontitis. J. Periodontal Res, 2003, vol. 38, no. 4, pp. 362-365.
20. Perinetti G. et al. Gingival crevicular fluid alkaline phosphatase activity as a non-invasive biomarker of skeletal maturation. Orthodontics & Craniofacial Res, 2011, vol. 14, no. 1, pp. 44-50.
21. Daltaban O. et al. Gingival crevicular fluid alkaline phosphatase levels in postmenopausal women: effects of phase I periodontal treatment. J. Periodontol., 2006, vol. 77, no. 1, pp. 67-72.
22. Miller R. Aging and immune function. Fundamental Immunology, 4th ed, ed. Paul W.E., Philadelphia, Lippincott-Raven Publ, 1999, pp. 974-965.
23. Todorovic T. et al. Salivary enzymes and periodontal. Med. Oral Patol. Oral Cir. Bucal, 2006, vol. 1, no. 11(2), pp. 115-119.
24. Nomura Y. et al. Screening of periodontitis with salivary enzyme tests. J. Oral. Sci., 2006, vol. 48, no. 4, pp. 177-183.
25. United Nations. Problems of the elderly and the agrd. Draft programme andarrangements for the World Assembly on the Elderly: report of the Secretary General. New York, 2011, pp. 72.
26. Zhura V.V., Rudova Yu.V. Bioethical aspects of medical discourse. Биоэтика, 2016, no. 1 (17), pp. 42-46.




















