from 01.08.2005 until now
Ufa, Ufa, Russian Federation
Ufa, Ufa, Russian Federation
Ufa, Ufa, Russian Federation
Russian Federation
Ufa, Ufa, Russian Federation
CSCSTI 76.29
Background. Periodontitis is a complex, multifactorial inflammatory disease. The prevalence in the adult population is 80-98%. The onset of the disease and the progression of the inflammatory process is associated with the colonization of the subgingival tooth surface with parodontopathogenic microorganisms. Objectives. The purpose is to study the prevalence of five oral microbes in subgingival plaque samples: Aggregatibacter actinomycetemcomitans (Aa), Porphyromonas gingivalis (Pg), Tannerella forsythia (Tf), Treponema denticola (Td), Prevotella intermedia (Pi) in oil and gas industry employees with chronic periodontitis and identify the presence connection between the clinical manifestations of periodontitis and the microbial profile of periodontal pockets. Methods. The study of periodontal microbiota was carried out in 32 workers in oil and gas industry employees with chronic periodontitis and in 32 patients with chronic periodontitis diagnosed not working in this field. Genomic DNA was extracted and 5 bacterial species were detected using the polymerase chain reaction. Results. Oil and gas industry employees with chronic periodontitis have their own flow peculiarities associated with the systematic influence of production factors. The most prevalent microorganism is Pg (77%), the presence of which is significantly associated with an increase in the depth of the periodontal pocket (PPD), clinical attachment loss (CAL), and an increase in the bleeding on probing (BOP). The pathogenic effect was manifested in the presence of the following microorganisms - the formation of the periodontal pocket in combination of Tf and Td, Tf and Pi, CAL level - Tf and Td, increased BOP index - Pg and Tf. Conclusions. As a result of the study, a connection was established between the red and orange complex bacteria with the clinical signs of chronic periodontitis. There was no significant association between age, smoking and the clinic of chronic periodontitis. Significant impact on the development of inflammatory periodontal diseases in oil and gas industry employees have harmful production factors.
petrochemical production, chronic periodontitis, red complex, PCR
Введение
Пародонтит является комплексным, многофакторным воспалительным заболеванием, затрагивающим опорные ткани зуба. В России его распространенность у населения в возрасте 35 лет и старше составляет 80–98 % и является основной причиной потери зубов [1]. Начало заболевания и прогрессирование воспалительного процесса тесно связаны с колонизацией поддесневой поверхности зуба микроорганизмами, включая Aggregatibacter actinomycetemcomitans, и представителями красного комплекса: Porphyromonas gingivalis, Tannerella forsythia и Treponema denticola. Консорциум патогенных бактерий, получивший название оранжевый комплекс, включающий Prevotella intermedia, является предшественником красного комплекса при колонизации десневого кармана. Наличие вышеперечисленных пародонтопатогенов в поддесневой зубной бляшке не во всех случаях является основной причиной развития деструктивных процессов и не всегда коррелируется с тяжестью заболевания. Важную роль играют восприимчивость организма и факторы внешней среды, включая производственные. В условиях нефтехимического производства на организм оказывает вредное влияние комплекс веществ, обладающих раздражающими, наркотическими, канцерогенными и общетоксическими свойствами, периодически превышающими уровень ПДК. В основное время рабочей смены уровень загрязнения воздуха рабочей зоны относительно невелик. Возможность воздействия непродолжительных колебаний содержания химических веществ выше ПДК может влиять на состояние здоровья полости рта. В условиях нефтехимического предприятия на организм работников оказывают влияние следующие вредные химические вещества: углеводороды алифатические предельные и непредельные (этилен, метан, этан, пропан); оксиды органические и перекиси (оксид этилена); спирты и их производные. По данным отдельных авторов, у работников нефтехимической отрасли течение пародонтита имеет особенности, связанные с систематическим неблагоприятным влиянием профессиональных вредных веществ: переход легких форм заболеваний в более выраженные, образование глубоких пародонтальных карманов, потеря уровня эпителиального прикрепления, выраженная подвижность зубов [2]. Исследования, посвященные изучению факторов производственной среды на состояние пародонта, в доступной литературе единичны, что определяет актуальность настоящего исследования.
Цель исследования — изучить распространенность Pg, Aa, Tf, Td, Pi в содержимом поддесневой зубной бляшки у работников нефтехимического производства с целью выявить наличие связи между клиническими проявлениями пародонтита и микробным профилем пародонтальных карманов.
Материалы и методы
Для исследования микробиоценоза пародонта были привлечены 32 работника основного производства завода окиси этилена нефтехимического комплекса с хроническим пародонтитом (основная группа) и 32 пациента с диагнозом «хронический пародонтит», не работающих на нефтехимических предприятиях, составивших контрольную группу. В обследуемые группы не включены лица с наличием менее 16 зубов, системными заболеваниями (сахарный диабет, болезнь Крона, ВИЧ-инфекция, онкология), проводившие лечение пародонта на протяжении последних 6 месяцев, принимавшие нестероидные противовоспалительные препараты в течение последнего месяца.
Перед забором материала был удален наддесневой налет, зуб изолирован ватными турундами и подсушен. Содержимое пародонтальных карманов и интактного пародонта отбирали с помощью стерильных бумажных эндодонтических штифтов (размер № 25), которые помещались в пародонтальный карман на 10 секунд. У каждого пациента проводился забор материала из трех участков: из самого глубокого пародонтального кармана на верхней и нижней челюстях, а также из десневого кармана глубиной < 3 мм без признаков воспаления. Затем материал помещали в стерильную пробирку и транспортировали в отдел токсикологии и генетики Уфимского научно-исследовательского института медицины труда и экологии человека. Молекулярно-генетические исследования включали определение маркерной ДНК пародонтопатогенных с помощью полимеразной цепной реакции (ПЦР). Использовался набор реагентов «Мультидент-5» (НПФ «Генлаб», Россия), чувствительность которого составляет 104 копий/мл, что является достаточным для выявления пародонтопатогенов для ранней диагностики заболевания. Для выделения ДНК применялся реагент «Реалекс» (НПФ «Генлаб», Россия). Детекцию продуктов ПЦР методом электрофореза проводили в агарозном геле. Для статистических расчетов использовали программный пакет IBM SPSS Statistics 23.0 (SPSS Inc, Chicago, IL, USA). Критерий χ2 применялся для сравнения частоты встречаемости микроорганизмов, U-критерий Манна — Уитни — в расчетах оценки статистического различия клинических характеристик и индексов между основной и контрольной группами. Для оценки межгрупповых различий использовался многомерный дисперсионный анализ, для идентификации микроорганизмов, значимо связанных с воспалительными процессами пародонта, — обратный пошаговый метод логистической регрессии. Достоверными считались различия при p <0,05.
Результаты и их обсуждение
Демографические и клинические характеристики пациентов представлены в табл. 1. Представители основной и контрольных групп сопоставимы по возрасту, полу, вредным привычкам и количеству зубов.
Таблица 1
Демографические и клинические характеристики изучаемых групп
Table 1. Demographic and clinical characteristics of studied groups
|
|
Работники нефтехимического производства (n=32) |
Контрольная группа (n=32) |
p-значение |
|
Мужской пол (%) Курение (%) Возраст (лет) Количество зубов |
100 65,60 47,3 ± 10,9 25,80± 3,80 |
100 63,60 45,6±10,0 26,70± 3,50 |
- >0,05 >0,05 >0,05 |
|
PPD (мм) CAL (мм) Распространенность PPD ≥3 мм (%) Упрощенный индекс гигиены (OHI-S) Пародонтальный индекс CPITN Индекс кровоточивости при зондировании (BOP* %) |
4,20±1,26 6,55±2,05 48,50±25,40 3,45±0,83 2,30±0,54 47,90±15,60 |
3,55±1,01 5,78±1,68 35,1± 20,4 3,16±0,84 2,0±0,52 39,2± 12,8 |
0,004 0,041 0,044 0,150 0,022 0,048 |
Примечание: * Bleeding on probing — Lang NP с соавт., 1986 г.
Проведенный анализ частоты воспалительных заболеваний пародонта показал, что у работников завода окиси этилена хронический пародонтит тяжелой степени встречается в 28,1 % случаев, средней — в 50, легкой — в 21,9. В контрольной группе хронический пародонтит тяжелой степени наблюдался лишь у 18,8 % пациентов, средней — у 53,1 и легкой — у 28,1. Глубина пародонтального кармана у пациентов основной группы составила 4,2 мм (ДИ 95 %, 2,94–5,46), что превышает значение в контрольной группе — 3,55 мм (ДИ 95 %, 2,54–4,56). Уровень потери эпителиального прикрепления также достоверно различался между группами: в основной — 6,55 мм (ДИ 95 %, 4,50–8,60) и в контрольной — 5,78 мм (ДИ 95 %, 4,10–7,46). Состояние гигиены полости рта изучали с помощью упрощенного индекса Green — Vermillion (OHI-S). Уровень гигиены в обеих группах низкий, статистических различий между ними не выявлено (p=0,15). Индекс CPITN использовался для мониторинга состояния тканей пародонта и как показатель потребности лечения болезней пародонта. Значение индекса в основной группе было достоверно выше (p=0,022). Связь между индексом CPITN и микробным профилем, курением установить не удалось. Так же в обеих группах отсутствует связь между видовым составом микроорганизмов поддесневой зубной бляшки и возрастом и курением. У пациентов, работающих в условиях вредного производственного воздействия, все сравниваемые клинические показатели хронического пародонтита были статистически выше, за исключением уровня гигиены. У 64 человек взято 192 образца содержимого пародонтального кармана. Как минимум один из изучаемых микроорганизмов обнаружен у каждого пациента. Частота встречаемости всех пяти микроорганизмов значительно выше в глубоких пародонтальных карманах (PPD≥3 мм). Наиболее часто определялся в основной и контрольной группах Pg, наименее — Td (табл. 2). По данным литературы, Porphyromonas gingivalis является наиболее распространенным грамотрицательным анаэробом наддесневой и поддесневой зубной бляшки [3]. Полученные нами результаты также указывают на его высокую распространенность в обеих группах (67—77 %).
Таблица 2
Количество и частота позитивных образцов в основной и контрольной группах с хроническим пародонтитом различной степени тяжести
Table 2. Number and prevalence of positive samples for the examined microorganisms
|
Микроорганизмы |
Частота обнаружения |
||||
|
пародонтальные карманы (PPD≥3 мм, CAL ≥ 4 мм), N(%) |
пародонтальные карманы (PPD <3 мм, CAL < 4 мм), N(%) |
||||
|
основная группа (n=64) |
контрольная группа (n=64) |
основная группа (n=32) |
контрольная группа (n=32) |
||
|
Красный комплекс |
Pg |
43 (67,2) |
49 (77,0) |
15 (46,9) |
16 (50,0) |
|
Tf |
16 (25,0) |
14 (21,9) |
1 (3,1) |
2 (6,2) |
|
|
Td |
2 (3,1) |
3 (4,7) |
0 (0) |
0 (0) |
|
|
Оранжевый комплекс |
Pi |
5 (7,8) |
2 (3,1) |
0 (0) |
0 (0) |
|
|
Aa |
27 (42,2) |
15 (23,4) |
8 (25,0) |
4 (12,5) |
Второй по распространенности микроорганизм — Aa, он выявлен в 27 образцах основной группы и в 15 — контрольной (42,2 и 23,4 %). Эти показатели близки к диапазону, полученному в результатах исследований других авторов (15—40 %) [4, 5]. Статистически значимое различие между группами установлено только у данного микроорганизма (критерий χ2, p=0,037). Распространенность представителя оранжевого комплекса Pi была не высокая — 7,8 % в основной группе и 3,1 — в контрольной. Частота встречаемости исследуемых микроорганизмов, взятых из участков с клинически здоровым пародонтом (PPD <3 мм и CAL <4 мм), также была значительно ниже, бактерии Td и Pi не были обнаружены ни у одного пациента. Выполнен дисперсионный анализ связей пародонтопатогенов с клиническими признаками (табл. 3).
Таблица 3
Дисперсионный анализ (критерии межгрупповых эффектов) значения микроорганизмов поддесневой зубной бляшки в формировании патологических изменений при хроническом пародонтите
Table 3. Dispersion analysis (intergroup effect criterion) of the significance of microorganisms of subgingival dental plaque in the formation of pathological changes in chronic periodontitis
|
Источник |
Зависимая переменная |
F |
Значимость |
|
Pg |
Глубина пародонтального кармана |
17,203 |
<0,001 |
|
Уровень потери эпителиального прикрепления |
15,680 |
<0,001 |
|
|
Pi |
Уровень потери эпителиального прикрепления |
5,320 |
0,023 |
|
Индекс кровоточивости при зондировании |
6,484 |
0,012 |
|
|
Pg*Tf |
Индекс кровоточивости при зондировании |
4,213 |
0,042 |
|
Pg*Pi |
Глубина пародонтального кармана |
9,648 |
0,002 |
|
Уровень потери эпителиального прикрепления |
6,898 |
0,010 |
|
|
Aa*Pi |
Глубина пародонтального кармана |
7,534 |
0,007 |
|
Индекс кровоточивости при зондировании |
7,439 |
0,007 |
|
|
Td*Tf |
Глубина пародонтального кармана |
18,520 |
<0,001 |
|
Уровень потери эпителиального прикрепления |
6,268 |
0,014 |
|
|
Tf*Pi |
Глубина пародонтального кармана |
4,283 |
0,041 |
Примечание: представлены только статистически значимые величины.
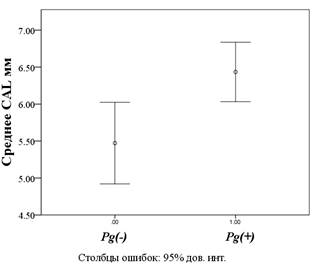
В процессе исследования нами была установлена зависимость между присутствием Pg и формированием пародонтальных карманов глубиной ≥3 мм (рис. 1) и потерей уровня эпителиального прикрепления ≥4 мм (p <0,001) (рис. 2). В случаях, когда в сообществе с Pg в собранном материале определялись и другие микрооргани змы из красного и оранжевого комплексов, патогенное воздействие только усиливалось.
змы из красного и оранжевого комплексов, патогенное воздействие только усиливалось.
Рис. 1. Зависимость глубины пародонтального кармана от присутствия Porphyromonas gingivalis
Fig. 1. Dependence of the depth of the periodontal pocket from the presence of Porphyromonas gingivalis
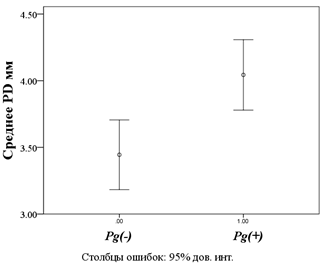
Рис. 2. Зависимость уровня потери эпителиального прикрепления от присутствия Porphyromonas gingivalis
Fig. 2. Dependence of the clinical attachment loss from the presence of Porphyromonas gingivalis
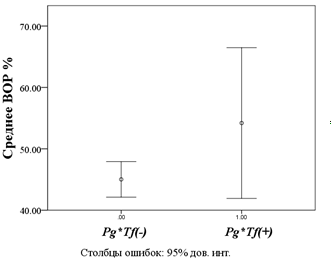
Полимикробная синергия Pg и Tf была доказана в результате ряда исследований с использованием экспериментальных моделей заболевания на животных [6]. В экспериментальных работах на мышах было показано, что в присутствии Pg воспаление было незначительным, после присоединения пародонтопатогенов из красного комплекса произошло существенное увеличение воспалительных процессов в тканях [7]. Сочетание Pg*Tf влияет на значения индекса BOP (p=0,042), в то же время, если они не находились одновременно в пародонтальном кармане, этой связи не наблюдалось (рис. 3). В ряде зарубежных исследований Tf рассматривается как один из основных этиологических факторов развития хронического пародонтита в случаях, когда микроорганизм прочно ассоциирован с другими пародонтопатогенами красного и оранжевого комплексов [8], что и нашло подтверждение в данной работе.
Рис. 3. Зависимость индекса кровоточивости при зондировании от присутствия сообщества микроорганизмов Porphyromonas gingivalis и Tannerella forsythia
Fig. 3. The dependence of the bleeding on probing index probing from the presence of the community of microorganisms Porphyromonas gingivalis and Tannerella forsythia
Присутствие Аа негативно влияет на PD ≥3 мм (p=0,006), а в комплексе с Pi еще и увеличивает показатели индекса BOP (p=0,007). Результаты дисперсионного анализа указывают на корреляцию Pi и патологические изменения уровня эпителиального прикрепления (p=0,023), а также с индексом BOP (p=0,012) и глубиной пародонтальных карманов в сообществе с Tf (p=0,041).
Статистический анализ не обнаружил значимой корреляции Аа. В данной работе не определялись серотипы Aa. На сегодняшний день доказано, что преимущественно серотип b Aa ассоциируется с воспалительными заболеваниями пародонта, в особенности с агрессивной формой пародонтита [9], распространенность которого зависит от географической и этнической принадлежности [10]. Присутствие сразу двух микроорганизмов Pg и Pi незначительно повышает вероятность увеличения показателя индекса кровоточивости при зондировании. Результаты анализа указывают, что помимо Pg на развитие и прогрессирование хронического пародонтита значительное влияние оказывает колонизация пародонтальных карманов микроорганизмом Pi. У работников завода окиси этилена наблюдались более выраженные изменения клинических показателей состояния пародонта по сравнению с контрольной группой, что проявлялось в образовании глубоких пародонтальных карманов, потери уровня эпителиального прикрепления, выраженной кровоточивости при зондировании.
Систематическое неблагоприятное влияние вредных веществ в концентрациях, превышающих ПДК, снижает защитно-компенсаторные функции организма у работников нефтехимических производств и приводит к усугублению признаков поражения пародонта.
Выводы
Выявлены достоверные различия в клинических проявлениях хронического пародонтита и микробного профиля (Aggregatibacter actinomycetemcomitans, p=0,037) у работников завода оксида этилена и пациентов контрольной группы в уровне потери эпителиального прикрепления (p=0,041), глубине пародонтального кармана (p=0,004), а также результатах индексов CPITN и BOP. Результаты статистического анализа указывают на незначительную роль Aa в риске развития воспалительных заболеваний пародонта (p>0,05). Дисперсионный анализ показал связь пародонтопатогенов красного и оранжевого комплексов с клиническими признаками хронического пародонтита. Не обнаружено значимой связи между возрастом, курением и клиникой хронического пародонтита. Учитывая характер сдвигов клинического статуса, можно предположить, что существенное влияние на развитие воспалительных заболеваний пародонта у работников нефтехимического комплекса оказывают вредные производственные факторы, преимущественно химические, в связи с чем требуются разработка и внедрение профилактических мероприятий.
1. Gazhva S.I., Guluev R.S. [Prevalence and intensity of periodontal inflammatory diseases]. Obozrenie. Stomatologiya = Review. Stomatology, 2012, no. 1, pp. 13-14. (In Russ.)
2. Kabirova M.F., Giniyatullin I.I., Bakirov A.B. [The impact of adverse factors during production of ethylbenzene and styrene on paradentium]. Kazanskiy meditsinskiy zhurnal = Kazan medical journal, 2008, vol. 89, no. 4, pp. 526-528. (In Russ.)
3. Checchi L., Gatto M.R., Carinci F. Bacteria prevalence in a large Italian population sample: a clinical and microbiological study. J Biol Regul Homeost Agents, 2016, vol. 30, pp. 199-208.
4. Tettamanti L., Gaudio R.M., Cura F., Mucchi D., Illuzzi N., Tagliabue A. Prevalence of periodontal pathogens among italian patients with chronic periodontitis: a retrospective study on 2992 patients. Oral Implantol, 2017, vol. 10, pp. 28-36.
5. Tomita S., Komiya-Ito A., Imamura K. et al. Prevalence of Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis and Tannerella forsythia in Japanese patients with generalized chronic and aggressive periodontitis. Microb Pathog, 2013, vol. 61-62, pp. 11-15.
6. Kesavalu L., Sathishkumar V., Bakthavatchalu C. et al. Rat model of polymicrobial infection, immunity, andalveolar bone resorption in periodontal disease. Infect. Immun., 2007, vol. 75.
7. Boutin S., Hagenfeld D., Zimmermann H., El Sayed N., Höpker T. et al. Clustering of Subgingival Microbiota Reveals Microbial Disease Ecotypes Associated with Clinical Stages of Periodontitis in a Cross-Sectional Study. Front Microbiol., 2017, vol. 8.
8. Puig-Silla M., Montiel-Company J.M., Dasí-Fernández F., Almerich-Silla J.M. Prevalence of periodontal pathogens as predictor of the evolution of periodontal status. Odontology, 2017, vol. 105, pp. 467-476.
9. Gholizadeh P., Pormohammad A., Eslami H., Shokouhi B. et al. Oral pathogenesis of Aggregatibacter actinomycetemcomitans. Microbial Pathogenesis, 2017, vol. 113, pp. 303-311.
10. Jentsch H., Cachovan G., Guentsch A., Eickholz P. et al. Characterization of Aggregatibacter actinomycetemcomitansstrains in periodontitis patients in Germany. Clin. Oral Investig, 2012, no. 14.