Екатеринбург, Свердловская область, Россия
Екатеринбург, Свердловская область, Россия
Использование различных форм лекарств для реминерализационной терапии, таких как зубные пасты, гели, суспензий, эликсиров и лаков, рекомендуется в ранних проявлениях износа зубов без потери зубной эмали белковой матрицы. Можно построить индикацию кристаллов гидроксиапатита для восстановление структуры эмали
износ зубов, эрозия, истирание, истирание, реминерализация, гидроксиапатит
Рекомендации по лечению и профилактике ранних проявлений ПСЗ с локализацией патологических элементов в виде эрозии или дефекта в пределах эмали (индекс Смита-Найта -1) носят эмпирический характер и сводятся к
• Коррекции режима приема пищи с исключением кислотных агентов.
• Щадящей гигиене полости рта
• Реминерализующей терапии по традиционной схеме (с использованием 10 % глюконат кальция, 2 % фторида натрия – фторлака).
Применение различных форм лекарственных средств для ремирерализующей терапии таких как зубные пасты, гели, суспензии, эликсиры и лаки целесообразно при ранних проявлениях ПСЗ без потери эмали зуба белковой матрицы. При этом возможно построение ориентировочных кристаллов гидроксиапатита и восстановление структуры эмали [1].
Одной из распространенных методик реминерализующей терапии является применение комбинации 10 % раствора глюконата кальция и 2-4 % фторида натрия путем аппликации на поверхность зуба с использованием метода электрофореза [2,3]. Профилактическое действие фторидов основано на восстанолвении физико-химических свойств деминерализованной эмали, снижении ее растворимости и ускорении процесса реминерализации. Установлено, что при использовании простых фторидов на поверхности эмали формируется относительно крупнокристаллические образования, размер которых не позволяет глубоко проникнуть внутрь дефекта эмали, что существенно снижает положительное воздействие и увеличивает количество необходимых процедур. Размер кристаллов фторида кальция равен 1000нм, что в сто раз больше диаметра эмалевых воронок (10нм), которые образуются под действием кислот бактерий зубного налета, поэтому в настоящее время широко применяется метод глубокого фторирования [4,5,6,7].
Лечение ПСЗ с точечным обнажением дентина (индекс Смита-Найта-2) симптоматическое и сводятся к снятию болевой чувствительности путем применения десенситайзеров и также проведению реминерализующей терапии. [8]
Цель исследования – оценка динамики показателей электрометрии и теста эмалевой резистентности у пациентов с ранними проявлениями повышенной стираемости зубов.
Материалы и методы исследования:
У всех 153 пациентов участников исследования были определены одиночные или множественные фасетки стирания твердых тканей зубов в пределах эмали или с точечным обнажением дентина без сочетанных кариозных поражений твердых тканей зубов. Всем пациентам был поставлен диагноз: Повышенная стираемость зубов (К03.0) I степени по Бушану, локализованная форма.
Критерии исключения из исследования:
1. Дисфункция височно-нижнечелюстного сустава
2. Гипертонус жевательных мышц.
3. Наличие болевого симптома, обусловленного оголением цемента корней зубов.
Исходя из глубины поражения твердых тканей в области фасеток стирания по классификации Смита-Найта пациенты были разделены на 2 группы: 1 группа – пациенты с локализацией фасеток стирания в пределах эмали (индекс Смита-Найта =1), 2 группа – пациенты с локализацией фасеток стирания в пределах верхних слоев плащевого дентина (точечное обнажение дентина, индекс Смита-Найта = 2). Группа контроля, 20 человек, принимали стандартное лечение в виде аппликации 10 % глюконата кальция в течение 3 минут с последующим покрытием зубов NaF 2 % – 5 процедур через день по методике (Боровский Е. В., Леус П. А.). Группа исследования, 26 человек, получали лечение в виде однократного покрытия поверхности зубов фармакологически-активной композицией нФАП в течение 5 минут с повторным нанесением через 1 месяц. Группа сравнения, 28 человек, получали лечение в виде аппликации геля ROCS Medical Minerals в каппе на 30 минут перед сном в течение 3 недель каждый день.
Изготовление новой фармакологической композиции нанодисперсного фторапатита кальция (нФАП) в виде суспензии производилось в Институте органического синтеза им. И. Я. Постовского УрО РАН (академик, д. х. н. Чупахин О. Н., д. х. н. Хонина Т. Г.) совместно с Институтом химии твердого тела (д. т. н. Сабирзянов Н. А., к. х. н. Богданова Е. А.) Вторая группа пациентов включала 79 человек. Группа контроля, 20 человек, принимали стандартное лечение в виде аппликации 10 % глюконата кальция в течение 3 минут с последующим покрытием зубов NaF 2 % – 5 процедур через день по методике (Боровский Е. В., Леус П. А.). Группа исследования, 30 человек, получали лечение в виде однократного покрытия поверхности зубов фармакологически-активной композицией НФАП в течение 5 минут с последующим покрытием герметиком ClinPro Varnish XT (3M). Процедура повторно повторялась через 1 месяц. Группа сравнения (29 человек) получали лечение в виде аппликации герметиком ClinPro Varnish XT (3M) с последующим повтором аппликации через 1 месяц.
Показатели ТЭР-теста и электрометрии оценивались до лечения, непосредственно после 1 нанесения препарата, через 1 месяц, 6 месяцев и через год.
Среднее значением показателя ТЭР-теста в первой группе пациентов составил 5,43±0,12. Группа контроля – 5,6±0,1, исследуемая группа – 5,2±0,2 и группа сравнения – 5,5±0,1. Значения ТЭР-теста у пациентов с ранними проявлениями повышенной стираемости на момент обращения до проведения курса реминерализующей терапии соответствуют среднему уровню кариес-резистентности.
Показатели ТЭР-теста после аппликации препаратов в первое посещение достоверно не отличаются от изначальных значений.
Через месяц после окончания назначенного курса лечения показатель ТЭР-теста в контрольной группе увеличился на 10,72 % и составил 5,0±0,1. В исследуемой группе показатель резистентности эмали улучшился на 23,08 % (4,0±0,2), тогда как в группе сравнения прирост составил только 14,55 % с показателем ТЭР-теста 4,7±0,1 соответственно.
Через пол года наблюдений в контрольной группе значение ТЭР-теста составило 5,3±0,2. Показатели теста в исследуемой группе 2,8±0,1 (+46,16 %) и 3,5±0,1 (+36,37 %), что соответствует высокому уровню кариес резистентности эмали зубов.
Через год наблюдений отметили отсутствие положительной динамики показателя кариес резистентности твердых тканей зубов пациентов контрольной группы. Значения ТЭР-теста увеличились на 51,93 % (2,5±0,2) у пациентов исследуемой группы 45,46 % (3±0,3) у пациентов группы сравнения.
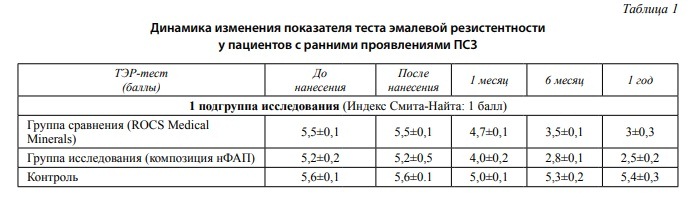
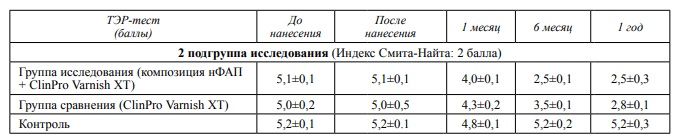
Среднее значение ТЭР-теста во второй группе исследования (индекс Смита-Найта-2) до лечения составило 5,1±0,3. Группа контроля – 5,2±0,1, исследуемая группа – 5,1±0,1 и группа сравнения – 5,0±0,2. Значения ТЭР-теста у пациентов с ранними проявлениями повышенной стираемости на момент обращения до проведения курса реминерализующей терапии соответствуют среднему уровню кариес-резистентности.
Показатели кариес резистентности эмали до и непосредственно после нанесения препаратов достоверно не отличались.
Через месяц после окончания назначенного курса лечения показатель ТЭР-теста в контрольной группе увеличился на 7,7 % и составил 4,8±0,1. В исследуемой группе положительная динамика показателя ТЭР-теста составила 21,57 % (4,0±0,1) против 14 % (4,3±0,2) в группе сравнения.
Контрольный осмотр пациентов через шесть месяцев продемонстрировал увеличение кариес резистентности эмали зубов группы исследования на 50,99 % (2,5±0,1) и 30 % (3,5±0,1) в группе сравнения. Значение теста у пациентов контрольной группы приближалось к показателю кариес резистентности до начала лечения.
Через год наблюдений значение теста у пациентов контрольной группы соответствовали показателю до курса лечения. Показатель ТЭР-теста за пол года наблюдений в группе исследования не изменился и составил 50,99 % положительной динамики (2,5±0,1), тогда как в группе сравнения значение ТЭР-теста увеличилось на 44 % и составило (2,8±0,1).
У пациентов 1 подгруппы исследования показатели электрометрии до и после нанесения реминерализующих средств достоверно не отличались: контрольная группа – 4,1±0,1, группа исследования – 4,1±0,2 и группа сравнения – 4,2±0,2. Через месяц наблюдений электропроводность эмали в группе исследования уменьшилась на 25 % – 3,0±0,1, в группе сравнения соответственно на 14,29 % – 3,6±0,1. Значительных изменений показателя электропроводности в контрольной группе на протяжении года наблюдений не отмечалось: положительная динамика показателя – 2,44 % после окончания курса лечения с восстановлением значения электропроводности эмали до исходного показателя через 6 месяцев.
Показатель электропроводности эмали зубов через 6 месяцев в группе исследования составил 2,0±0,3 (+51,22 %), в группе сравнения 3,7±0,2 (+11,91 %). Через год наблюдений наблюдали повышение электропроводности эмали: группа исследования – 2,8±0,3 и группа сравнения – 3,8±0,1.
Наилучший показатель по снижению электропроводности эмали в группе сравнения наблюдали через месяц – 14,29 %. Через 6 месяцев и год наблюдений показатель электрометрии незначительно увеличивался на 2,38 % соответственно.
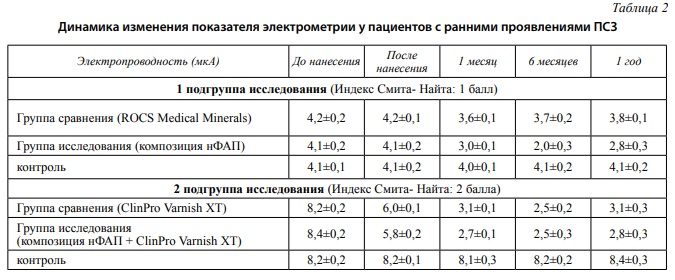
Во второй подгруппе исследования (индекс Смита-Найта – 2) средний показатель электрометрии составил 8,26±0,45. Контрольная группа – 8,2±0,2, группа исследования – 8,4±0,2 и группа сравнения – 8,2±0,2. Показатель электропроводности эмали в контрольной группе после нанесения реминерализующих средств не изменился – 8,2±0,1.
В группе исследования непосредственно после аппликации фармакологической активной композиции нФАП с последующим нанесением герметика ClinPro Varnish XT (3M) показатель электрометрии снизился на 30,96 % и составил 5,8±0,2. Покрытие эмали зуба одним герметиком в группе сравнения также продемонстрировало снижение показателя на 26,83 % – 6,0±0,1 соответственно.
Значительных изменений показателя электропроводности в контрольной группе на протяжении года наблюдений не отмечалось: положительная динамика показателя – 1,21 % после окончания курса лечения с восстановлением значения электропроводности эмали до исходного показателя через 6 месяцев.
Через месяц наблюдений показатель электрометрии в группе исследования составлял 2,5±0,3 (70,24 %) против 2,5±0,2 (69,52 %) в группе сравнения. Через год наблюдений наблюдался рост показателя электрометрии: в группе исследования на 3,57 % – 2,8±0,3 и на 7,3 % – 3,1±0,3 в группе сравнения.
Выводы:
1. Применение фармакологически-активной композиции нФАП в эксперименте продемонстрировало повышение показателя кариес резистентности эмали зубов в 2 раза с сохранением эффекта до одного года наблюдений. Курс из двух аппликаций препарата нФАП с интервалом в один месяц в условиях кабинета врача-стоматолога демонстрирует идентичные показатели повышения ТЭР-теста как и домашнее использование препарата ROCS Medical Minerals в течение 3 недель.
2. Применение герметика ClinPro Varnish XT (3M) а также его сочетания с фармакологически-активной композиции нФАП позволило повысить кариес резистентность эмали зубов в 2 раза с сохранением стойкого результата на протяжении года наблюдений. Введение в схему лечения ранних проявлений повышенной стираемости зубов фармакологически-активной композиции нФАП позволило улучшить эффект лечения на 20,99 % через пол года наблюдений и на 6,9 % через год.
3. Фармакологически-активная композиция нФАП в эксперименте демонстрирует уменьшение электропроводности эмали на 25 % через месяц после аппликации твердых тканей зуба. Максимальный эффект наблюдается через 6 месяцев – снижение показателя в 2 раза. Через год наблюдений показатель электропроводности увеличился на 28,58 %, но по прежнему был ниже в 1,4 раза исходных значений до начала лечения.
4. Непосредственно после нанесения герметика ClinPro Varnish XT (3M) показатели электрометрии снижаются на 26,8 %. Комбинация герметика и фармакологически-активной композицией нФАП в динамике наблюдений до года демонстрирует снижение показателя электропроводности эмали зубов на 9,6 % в сравнении с одиночным нанесением герметика.
1. Fowler CE, Gracia L, Edwards MI, Willson R, Brown A, Rees GD. Fluoride penetration from toothpastes into incipient enamel erosive lesions investigated using dynamic secondary ion mass spectrometry. J Clin Dent. 2009;20:186- 91.
2. Богданова Е. А. Физико-химические свойства биоактивных композиционных материалов на основе фосфатов кальция и кремнийорганических соединений/Диссертационная работа на соискание степени кандидата химических наук Богдановой Е. А. - Екатеринбург 2012 г.
3. L. M. Rodr guez-Lorenzo, J. N. Hart, K. A. Gross, Biomaterials. - 2003. V. 24 - P. 3777.
4. Петрович Ю. А., Леонтьев В. К., Подорожная Р. П. Транспорт карбоната, цитрата и селена между эмалью и ротовой жидкостью - Российский стоматологический журнал № 3 / 2013 - 10-17 С
5. Старченко В. И., Скориков В. Ю., Стариков П. А., Старченко Т. П., Зерватто Т. Особенности ортопедического лечения пациентов с низкой коронковой частью зуба Международный журнал прикладных и фундаментальных исследований No2, 2014 С172-175
6. Villacampa A. I., Garc a-Ruiz J. M. Synthesis of a new hydroxyapatite-silica composite material // J. Crystal Growth. - 2000. - V. 211. - 1 4. - P. 111 115.
7. Eans E. D., Hailer A. W. // Caleif. Tissue Int. - 1998. - V. 63. - P. 250 257. 8. Болезни зубов и полости рта [Электронный ресурс]: учебник / Макеева И. М., Сохов С. Т., Алимова М. Я. и др. - М.: ГЭОТАР-Медиа, 2012.






