с 01.01.2008 по настоящее время
Тюмень, Россия
Тюмень, Тюменская область, Россия
Тюменская область, Россия
Астрахань, Астраханская область, Россия
Предмет. Лечение катарального гингивита у пациентов сопровождалось проведением цитологического исследования краевой десны. Подсчитывалось количество эпителиальных и соединительнотканных клеток, проводилась их цитоморфометрия с определением морфологических классов деструкции клеток и показателей их функциональной морфологии в виде среднего показателя деструкции клеток (СПД), индекса цитолиза клеток (ИЦК), индекса деструкции клеток (ИДК). Цель — провести цитоморфометрию клеток тканей пародонта до и в процессе лечения пациентов с хроническим катаральным гингивитом. Методология. Распространенность воспалительного процесса в десне оценивали с помощью пародонтального индекса PMA и индекса кровоточивости десневой борозды (sbi) по Miihlemann и Son. Определялся гигиенический индекс Грин—Вермильона. Для цитологического исследования материал забирался цитощеткой на предметное обезжиренное стекло в виде однократного соскоба в месте очага воспаления маргинальной десны (место забора не менялось в течение всего исследования), фиксировался на стекле и передавался в цитологическую лабораторию. Далее его исследовали под микроскопом в 5 полях зрения. Статистическая обработка результатов осуществлялась в программе Statistika 6.0. Результаты. При изучении цитограмм пациентов со здоровым пародонтом отмечались в небольшом количестве лимфоциты (36±14), моноциты (6±1,87), плазмоциты (4±1,87), макрофаги (1±1), нейтрофилы 96±29,89. С хроническим катаральным гингивитом количество лимфоцитов — 4150±108,1; нейтрофилов — 1150±356,8; плазмоцитов — 60±16,6; макрофагов — 48,3±6,35; моноцитов — 21,6±2,5. Наиболее ярко отражают изменение клинической картины лимфоциты, макрофаги и нейтрофилы, так как их количество в течение 14 дней снизилось в 14,5, 12,8 и 7,32 раза соответственно. Выводы. Проведена цитоморфометрия клеток краевой десны при лечении катарального гингивита. Данный метод является информативным для оценки воспалительного процесса тканей пародонта, может использоваться для экспресс- диагностики заболеваний пародонта, определения эффективности проведенного лечения, прогноза обострения, а также является дешевым и легкодоступным.
цитоморфометрия, индекс деструкции клеток, индекс цитолиза клеток, экспресс-диагностика воспалительных заболеваний пародонта
Введение
По статистическим данным более 50 стран мира, распространенность заболеваний пародонта у населения составляет от 52 до 100 %. В последние годы в России отмечается рост воспалительных заболеваний пародонта, таких как катаральный гингивит и пародонтит [3, 4, 7, 8, 12, 14, 16, 21]. Многие годы ученые изучают процесс возникновения и поддержания воспалительного процесса в тканях пародонта. Ранее было выдвинуто много теорий, однако почти все ученые с большой уверенностью признают главенствующую роль двух факторов: это микроорганизмы и защитные факторы иммунитета. Полость рта является уникальной биологической нишей, в ней находятся около 500 различных бактерий, среди которых есть и патогенные бактерии, но не в значительном количестве [1, 3, 6, 10, 11; 13, 15, 20, 22]. Состояние и количество этих бактерий может меняться, однако не всегда наступает патологический процесс и не всегда развивается заболевание [14, 18, 19, 23, 25]. Пародонтопатогенные бактерии в процессе своей жизнедеятельности выделяют в подлежащие ткани продукты своей жизнедеятельности, токсины и ферменты. Именно они и запускают иммунный ответ макроорганизма [5]. Дальнейшее развитие процесса зависит от ответной реакции организма на присутствие патогенной микрофлоры. Ткани пародонта пронизаны клетками защиты: лимфоцитами, макрофагами, нейтрофилами, которые легко проникают из десневой жидкости посредством проницаемости эпителия борозды. Через него идет постоянное движение биологических веществ в обе стороны. Со стороны глубоких слоев эпителия в более поверхностные и в просвет борозды поступают иммунокомпетентные клетки и слущенный эпителий. Со стороны полости рта происходит диффузия метаболитов зубной бляшки (токсинов, ферментов, антигенов, митогенов, хемотаксического фактора). Этот процесс постоянного обновления эпителия является одним из адаптационных механизмов. Соединительный эпителий десневой борозды и собственно сам эпителий являются барьером, защитой для всех тканей пародонта от внешнего воздействия. В первой линии обороны врожденного иммунитета стоят фагоциты — это нейтрофилы, макрофаги, а также белки острой фазы, цитокины и компоненты комплемента. Для проникновения в ткани пародонта микроорганизмы сначала должны преодолеть механическую преграду, клетки эпителия, которые имеют свойство постоянно слущиваться. Таким образом, можно проследить развитие ответной реакции организма на внедрение патогенной микрофлоры в ткани посредством цитологического анализа тканей и жидких сред пародонта.
Цель исследования — определение количественного и качественного состава клеток тканей пародонта до и в процессе лечения пациентов с хроническим катаральным гингивитом.
Материалы и методы. В исследовании участвовали 37 пациентов в возрасте от 18 до 55 лет, из них 10 были с интактным пародонтом, в анамнезе у которых отсутствовал когда-либо воспалительный процесс десны, и 27 — с диагнозом «хронический катаральный гингивит», признаки заболевания которого сохранялись от 1 года до 3 лет. На основании полученных при осмотре клинических и рентгенологических данных диагноз устанавливался в соответствии с международной классификацией болезней (МКБ-10). Клиническими признаками воспаления в первую очередь являлись жалобы пациентов на дискомфорт, болезненность в области десен, кровоточивость разной степени, неприятный запах изо рта. При осмотре десна отечная, гиперемированная, кровоточит при зондировании, имеется разного уровня наличие мягкого зубного налета и над- и поддесневых твердых зубных отложений. Зубодесневое прикрепление при этом сохранено и снижение высоты вершин межзубных перегородок на рентгеновском снимке не отмечается.
Критерием включения пациентов в исследования был верифицированный диагноз «хронический катаральный гингивит», критериями исключения: наличие ортопедических конструкций, количество удаленных зубов более двух, беременность, климактерический синдром, алкогольная и наркотическая зависимости, соматические заболевания в стадии декомпенсации.
Клиническое обследование больных включало осмотр, опрос, сбор анамнеза жизни. Распространенность воспалительного процесса в десне оценивали с помощью пародонтального индекса PMA, определения гигиенического индекса Грин—Вермильона и индекса кровоточивости десневой борозды (sbi) по Miihlemann и Son. Пациенты получали традиционное лечение: профессиональную гигиену полости рта с сопутствующей мотивационной беседой к сохранению пациентами стоматологического здоровья и подбором для них средств индивидуальной гигиены. Также пациентам была назначена противовоспалительная и противомикробная терапия в соответствии с протоколом ведения больных с заболеваниями пародонта (разработан ГБОУ ВПО «МГМСУ им. А.И. Евдокимова» Минздравсоцразвития РФ (Янушевич О.О., Кузьмина Э.М., Максимовский Ю.М., Малый А.Ю., Дмитриева Л.А., Ревазова З.Э, Почтаренко В.А., Цицкишвили В.Т., Эктова А.И., Яковенко Н.В.) и ФГБУ «ЦНИИСиЧЛХ» Минздравсоцразвития РФ (Вагнер В.Д., Грудянов А.И.)). Контрольные осмотры проводились до начала лечения, на 2-е, 7-е, 14-е сутки и через 1 месяц. Для цитологического исследования материал забирался цитощеткой на предметное обезжиренное стекло в виде однократного соскоба в месте очага воспаления маргинальной десны. Место забора не менялось в течение всего лечения.
Результаты и обсуждение. Эффективность фагоцитоза зависит от количества и функций клеток, присутствующих в очаге воспаления. Одновременно с клиническим осмотром пациента и проведением индексов нами проводился соскоб с участка десны. Полученный материал фиксировался на стекле и передавался в цитологическую лабораторию. Далее отпечатки исследовали под микроскопом в 5 полях зрения. Подсчет проводился двух клеточных популяций: эпителиальной и соединительнотканной. Одними из первых в линию защиты включаются лимфоциты и нейтрофилы. Они высвобождают цитокины и способствуют активации макрофагов, которые, в свою очередь, производят фагоцитоз. При изучении цитограмм пациентов со здоровым пародонтом были обнаружены в небольшом количестве лимфоциты (36±14), моноциты (6±1,87), плазмоциты (4±1,87), макрофаги (1±1), чуть более нейтрофилов (96±29,89) (табл.1). У пациентов же с имеющимся катаральным гингивитом в 0 точке забора количество нейтрофилов и лимфоцитов составляет 4150±108,1 и 1150±356,8 соответственно, что подтверждает бактериальное и пролиферативное воспаление и говорит об активации факторов неспецифического и специфического иммунитета в тканях пародонта. На 1 контрольной точке лечения после проведения профессиональной гигиены полости рта и назначения противовоспалительной и антибактериальной местной терапии количество лимфоцитов резко снизилось до 165,5±135 (в 7,32 раза) и дальше продолжило свое снижение, но уже не так выраженно: на 7-й день — до 130±50,3 и на 14-й — до 157,5±113,3. У пациентов, проходящих лечение, количество плазмоцитов и макрофагов было 60±16,6 и 48,3±6,35 соответственно. Плазматические клетки участвуют в синтезе иммуноглобулинов и отражают эффективность гуморального иммунитета. Чем более выражено воспаление в тканях, тем большее количество плазматических клеток преобладает в воспалительном очаге: их более чем в 15 и 48 раз больше, чем в группе контроля при здоровом пародонте. В ходе лечения на 2-й и 7-й дни количество плазмоцитов уменьшилось до 30̉±12,5 и 16,25±8,6, а макрофагов — до 32,5±27,5 и 15±8,66. Макрофаги продолжили свое активное снижение и на 14-й день в очаге воспаления их было 3,75±2,39, что в 12,8 раза меньше от первоначального значения. Моноциты не сильно отражали тенденцию к выздоровлению, постепенно снижалось их количество от 21,6±2,5 в 0 точке до 7,57,5±5,95 на 14-й день, однако через месяц их количество опять установилось на отметке 20±0. Остальные показатели уменьшились в 1,23—2,29 раза от первоначальных значений. Это говорит об эффективности проводимой терапии. Наиболее ярко отражают клиническую картину лимфоциты, макрофаги и нейтрофилы, так как их количество в течение 14 дней снизилось в 14,5; 12,8 и 7,32 раза соответственно (табл. 1).
Таблица 1
Количественные показатели клеточных элементов десны в контрольной группе и группе в процессе лечения хронического катарального гингивита
Table 1. Quantitative indices of gingival cellular elements in reference group and in group of chronic catarrhal gingivitis treatment
|
Клетки |
До лечения |
На 2-й день лечения |
На 7-й день лечения |
На 14-й день лечения |
Через 1 месяц (7 человек) |
Контрольная группа (10 человек) |
|
Нейтрофилы |
4150±108,1 |
1812±820,3 |
450±270 |
285±195,9 |
332±44,7 |
96±29,89 |
|
Лимфоциты |
1150±356,8 |
165,5±135 |
130±50,3 |
157,5±113,3 |
190±10 |
36±14 |
|
Плазмоциты |
60±16,6 |
30̉±12,5 |
16,25±8,6 |
15±4,08 |
20±0 |
4±1,87 |
|
Макрофаги |
48,3±6,35 |
32,5±27,5 |
15±8,66 |
3,75±2,39 |
10±0 |
1±1 |
|
Моноциты |
21,6±2,5 |
17,5 |
16,25±8,6 |
7,5±5,95 |
20±0 |
6±1,87 |
Стоит отметить, что до 14 дней наблюдения все показатели закономерно снижались, однако через 1 месяц их количество незначительно повысилось (рис. 1). Вероятно, это может быть ответной реакцией местного иммунитета на незначительное повышение пародонтальных индексов, ухудшением индивидуальной гигиены полости рта у пациентов (рис. 2).
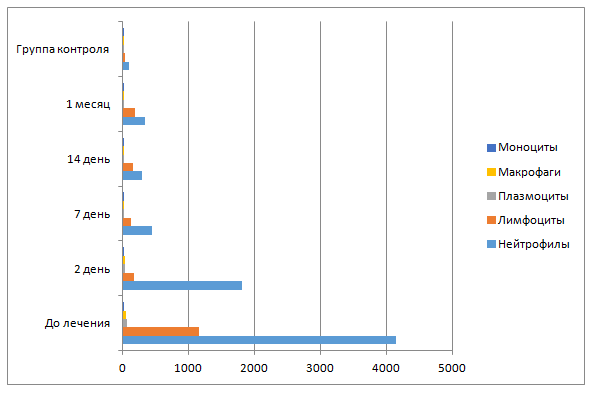
Рис. 1. Динамика показателей соединительнотканных клеток при лечении пациентов с хроническим катаральным гингивитом
Fig. 1. Indicators dynamics of connective tissue cells in treatment of patients with chronic catarrhal gingivitis
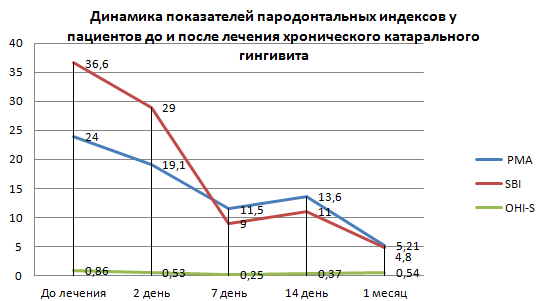
Рис. 2. Динамика показателей пародонтальных индексов у пациентов с хроническим катаральным гингивитом
Fig. 2. Indicators dynamics of periodontal indices for patients with chronic catarrhal gingivitis
Эпителий полости рта является первой линией защиты от проникновения бактерий. Он является частью мукозальной системы и используется в диагностике в качестве индикатора местных и общих нарушений гомеостаза [7, 2, 16, 24]. По морфологическим критериям нами были проведены расчеты и определены типы деструкции эпителиальных клеток. Были выявлены особенности состояния клеток, их цитопатология по морфологическим критериям (табл. 2, 3).
Таблица 2
Морфологические критерии деструкции клеток по классам
Table 2. Morphological criteria in cell destruction classification
|
Номер класса деструкции |
Цитоплазма клетки |
Ядро клетки |
|
0 |
Нормальная структура |
Нормальная структура |
|
1 |
Частичное (не более 1\2) деструктивное повреждение |
Нормальная структура |
|
2 |
Значительное (более 1\2, но не полное) деструктивное повреждение |
Частичное деструктивное повреждение |
|
3 |
Полная деструкция |
Значительная (но не полная) деструкция |
|
4 |
Полная деструкция с распадом |
Полная деструкция с распадом |
Таблица 3
Цитологические показатели функциональной морфологии клеток
Table 3. Cytological indicators of cell functional morphology
|
№ формулы |
Показатель |
Расчетная формула |
Условные обозначения |
|
1. |
Средний показатель деструкции клеток (СПД) |
СПД= 1*n1+2*n2+3*n3+4*n4 100 |
1, 2, 3, 4 — номера классов деструкции; n1, n2, n3, n4 —количество клеток соответствующего класса; 100 — количество исследованных клеток
|
|
2. |
Индекс цитолиза клеток (ИЦК) |
ИЦК=___n4____________ n0+n1+n2+n3+n4 |
|
|
3. |
Индекс деструкции клеток (ИДК) |
ИДК= n1+n2+n3+n4 100 |
Количество клеток без деструкции, как и должно быть в норме, было значительным и при первом обследовании составляло более 94,0 ±12,5 от общего количества. После проведенного лечения их количество увеличилось до 97,0 ±4,45. Количество деструктивных клеток с повреждением ядра и цитоплазмы уменьшалось после лечения и более активно это происходило в момент начала лечения. Значительно поменялось количество 2 и 3 классов деструкции с уменьшением в 2 и 3 раза от начальных значений соответственно. Через месяц отмечается незначительное повышение показателя клеток с 1 и 4 классами деструкции, а показатели 2 и 3 классов немного снижаются. Из этого можно сделать вывод, что повреждения 1 и 2 классов имеют обратимый характер и на фоне проводимого лечения часть клеток восстанавливаются. У другой же части клеток повреждения прогрессируют и класс деструкции увеличивается (табл. 4).
Таблица 4
Морфологические критерии деструкции эпителиальных клеток по классам маргинальной десны в процессе лечения пациентов с хроническим катаральным гингивитом, %
Table 4. Morphological criteria of epithelial cell destruction in marginal gingival classes for patients with chronic catarrhal gingivitis treatment, %
|
Классы деструкции клеток |
До лечения |
На 2-й день лечения |
На 7-й день лечения |
На 14-й день лечения |
Через 1 месяц
|
|
0 класс |
94,0 ±12,5 |
97,0 ±8 |
96,8 ±6,42 |
97,0 ±4,45 |
96,0 ±7 |
|
1 класс |
1,8 ±3,32 |
1,4 ±3 |
1,1 ±1,79 |
1,8 ±2,51 |
2,2 ±1,5 |
|
2 класс |
1,9 ±4,03 |
0,8 ±2,5 |
0,6 ±0,75 |
0,6 ±1,43 |
0,5 ±0 |
|
3 класс |
1,6 ±3,35 |
0,5 ±1,5 |
0,8 ±2,42 |
0,5 ±1,19 |
0,5 ±0,5 |
|
4 класс |
0,7 ±2,28 |
0,3 ±1 |
0,7 ±2,02 |
0,1 ±0,28 |
0,8 ±1,41 |
Выводы
В нашем исследовании мы наблюдали изменение клеточного пейзажа в ходе лечения хронического катарального гингивита. При изучении цитограмм пациентов со здоровым пародонтом были обнаружены в небольшом количестве лимфоциты (36±14), моноциты (6±1,87), плазмоциты (4±1,87), макрофаги (1±1) и нейтрофилы (96±29,89). У пациентов с хроническим катаральным гингивитом количество лимфоцитов составляло 4150±108,1, нейтрофилов — 1150±356,8, плазмоцитов — 60±16,6, макрофагов — 48,3±6,35, моноцитов — 21,6±2,5. Наиболее ярко отражают клиническую картину лимфоциты, макрофаги и нейтрофилы, так как их количество в течение 14 дней снизилось в 14,5, 12,8 и 7,32 раза соответственно. Полученные нами в результате исследования цитоморфометрические показатели доказывают, что цитологический метод исследования десны у пациентов с воспалительными заболеваниями пародонта является объективным и свидетельствует об активности протекающих реакций специфического и неспецифического иммунитета. Он может являться методом для быстрого экспресс-анализа, а также методом, имеющим четкие цифровые значения, которые позволят выявить начало заболевания или его обострение на доклинических стадиях, помогут оценить эффективность проводимого лечения.
1. Барер, Г. М. Роль интерферона и других цитокинов в возникновении и развитии заболеваний пародонта / Г. М. Барер, А. С. Григорян, Н. В. Постнова // Cathedra. - 2006. - Т. 5, № 3. - С. 54-60.
2. Быков, В. Л. Иммунокомпетентные клетки десны человека в норме и при воспалительных заболеваниях пародонта / В. Л. Быков // Архив патологии. - 2005. - № 2. - С. 51-55.
3. Грудянов, А. И. Состав пародонтопатогенной микрофлоры при пародонтите разных степеней тяжести по данным полимеразной цепной реакции / А. И. Грудянов, В. В. Овчинникова // Стоматология. - 2008. - Т. 87, № 3. - С. 20-23.
4. Дмитриева, Л. А. Пародонтит / Л. А. Дмитриева. - М.: МЕДпресс-информ. - 2013. - 506 с.
5. Елисеева, А. Ф. Роль смешанной инфекции в развитии хронического генерализованного пародонтита и ишемической болезни сердца / А. Ф. Елисеева, А. В. Цимбалистов, Г. Б. Шторина // Институт стоматологии. - 2012. - Т.2. - №55. - С. 78-79.
6. Иорданишвили, А. К. Заболевания эндодонта, пародонта и слизистой оболочки полости рта / А. К. Иорданишвили. - Москва : МЕДпресс-информ, 2008. - 344 с.
7. Куркин, А. В. Реактивность буккального эпителия у детей / А. В. Куркин, Д. Х. Рыбалкина // Морфология. - 2010. - Т. 137, № 4. - С. 108-109.
8. Лукиных, Л. М. Хронический генерализованный пародонтит. Часть 1. Современный взгляд на этиологию и патогенез / Л. М. Лукиных, Н. В. Круглова // Современные технологии в медицине. - 2011. - № 1. - С. 123-125.
9. Эпидемиологическое исследование распространенности пародонтопатогенной микрофлоры полости рта у населения России / А. М. Соловьева, С. К. Матело, А. А. Тотолян [и др.] // Стоматология. - 2005 - № 5. - С. 14-20.
10. Тец, В. В. Роль микрофлоры полости рта в развитии заболеваний человека / В. В. Тец // Стоматология. - 2008. - Т. 87, № 3. - С. 76-80.
11. Улитовский, С. Б. Проблемы пародонтологии и современные пути их решения / С. Б. Улитовский, Е. С. Алексеева, А. А. Васянина // Пародонтология. - 2015. - Т. 20, № 3. - С. 33-36.
12. Царев, В. Н. Микробная флора полости рта при развитии патологических процессов / В. Н. Царев, Р. В. Ушаков, М. Н. Давыдова // Микробиология, вирусология, иммунология. - 2009. - С. 483-502.
13. Некоторые аспекты этиологии и патогенеза хронических воспалительных генерализованных заболеваний пародонта / Л. М. Цепов, Л. Ю. Орехова, А. И. Николаев, Е. А. Михеева // Пародонтология. - 2005. - № 2. - С. 3-6.
14. Цепов, Л. М. Роль микрофлоры в возникновении воспалительных заболеваний пародонта / Л. М. Цепов, Н. А. Голева // Пародонтология. - 2009. - № 1. - С. 7-12.
15. Цепов, Л. М. Пародонтит: локальный очаг серьезных проблем / Л. М. Цепов, Е. Л. Цепова, А. Л. Цепов // Пародонтология. - 2014. - № 3(72). - С. 3-10.
16. Юй, Р. И. Цитологический анализ слизистой оболочки полости рта как достоверный критерий оценки ее гистофи- зиологии, патологии и эффективности лечений / Р. И. Юй // Вестник Каз НМУ. - 2006. - № 1. - С. 299-314.
17. Матриксные металлопротеиназы при заболеваниях пародонта / Т. В. Шинкаренко, В. А. Румянцев, Е. Н. Егорова, Т. И. Елисеева // Стоматология. - 2013. - Т. 92, № 2. - С. 77-80.
18. Artese L., Piattelli A., de Gouveia Cardoso L.A., Ferrari D.S., Onuma T., Piccirilli M., Faveri M., Perrotti V., Simion M., Shibli J.A. Immunoexpression of angiogenesis, nitric oxide synthase, and proliferation markers in gingival samples of patients with aggressive and chronic periodontitis. J. Periodontol, 2010, vol. 81, no. 5, pp. 718-726.
19. Kornman K.S. Mapping the pathogenesis of periodontitis: a new look. J. Periodontol., 2008, vol. 79, no. 8, pp. 1560-1568.
20. Murray D.A., Wilton J.M. Lipopolysaccharide from the periodontal pathogen Porphyromonas gingivalis prevents apoptosis of HL60-derived neutrophils in vitro. Infect. Immun, 2003, vol. 71, no. 12, pp. 7232-7235.
21. Murray J.J. Steele, Nunn J.H., Steel J.G. The Prevention of Oral Disease. Oxford University Press, 2003, 296 p.
22. Trevilatto P.C., de Brito Jr R.B., Scarel-Caminaga R.M., de Souza A.P., de Souza C.M., Sallum A.W., Line S.R.P. Polymorphism in the tumor necrosis factor-alpha gene (TNFA - 308 G/A) is not associated with susceptibility to chronic periodontitis in a Brazilian population. Dentistry 3000, 2015, vol. 3, no. 1. DOI:https://doi.org/10.5195/d3000.2015.27
23. Vita J.A. Endothelial function. Circulation, 2011, vol. 124, no. 25, pp. 906-912.
24. Zhou J., Yan J., Liang H., Jiang J. Epinephrine Enhances the Response of Macrophages under LPS Stimulation. Biomed Res. Int., 2014, vol. 2014.
25. Zoellner H. Dental infection and vascular disease. Semin. Thromb. Hemost., 2011, vol. 37, no. 3, pp. 181-192.






















