с 01.09.2010 по настоящее время
ГРНТИ 76.29 Клиническая медицина
Предмет. Успех комплексной реабилитации пациентов методом дентальной имплантации в условиях дефицита костной ткани челюстей в области дефектов зубных рядов определяется множеством факторов, играющих важную роль на различных этапах проведения лечения. Дентальная имплантация при сложных дефектах альвеолярной кости челюсти требует предварительной реконструкции с применением костнозамещающих материалов, успех которой зависит от площади контакта реконструктивного костного имплантата с аутогенной костной тканью, степени его реваскуляризации и первичной стабилизации. Цель — расширение показаний к дентальной имплантации при выраженной атрофии костной ткани челюстей в области дефекта зубных рядов путем применения индивидуальных реконструктивных имплантатов из лиофилизированного аллогенного материала. Методология. Изготовление прецизионного реконструктивного костного имплантата из аллогенного биоматериала проводили с помощью методик цифровой реконструкции, основанных на построении виртуальных цифровых 3D-моделей по данным компьютерной томографии. Для оценки результатов лечения пациента с выраженной атрофией костной ткани челюстей в области дефектов зубных рядов применяли общеклинические и специальные методы исследования: конусно-лучевую компьютерную томографию, денситометрию костной ткани челюстей, периотестметрию; реопародонтографию; изучение качества жизни. Результаты. Использование реконструктивного имплантата из лиофилизированного аллогенного материала приводит к увеличению площади его контакта с аутогенной костной тканью альвеолы, увеличению его реваскуляризации, остеокондуктивного потенциала, снижению вероятности его отторжения и осложнений в постоперационном периоде, расширению показаний к дентальной имплантации. Вывод. Применение индивидуальных реконструктивных имплантатов из лиофилизированного аллогенного материала при выраженной атрофии костной ткани в области дефектов зубных рядов челюстей позволяет значительно расширить показания к дентальной имплантации и сократить общую продолжительность лечения в среднем на 6 месяцев за счет одномоментного проведения аугментации и имплантации.
дентальная имплантация, атрофия костной ткани челюстей, реконструкция альвеолярной кости челюстей, индивидуальный реконструктивный имплантат из лиофилизированного аллогенного материала
Введение
Успех комплексной реабилитации пациентов методом дентальной имплантации в условиях дефицита костной ткани челюстей определяется множеством факторов, играющих роль на различных этапах проведения лечения [1—11].
Планирование дентальной имплантации при сложных по форме горизонтальных и вертикальных дефектах альвеолярной кости челюсти требует предварительной реконструкции с применением костнозамещающих материалов, что удлиняет сроки лечения на 6—8 месяцев [12—22].
При обеспечении стабильности используемого материала важны как первичная механическая, так и биологическая фиксации, то есть процессы остеоинтеграции, протекающие в области соприкосновения с реципиентной костной тканью. Очевидно, что чем плотнее прилегание материала к области дефекта и чем больше площадь их контакта, тем оптимистичнее прогноз костной реконструкции [23, 24]. Этим продиктована актуальность создания технологии построения индивидуальных костных имплантатов, расширяющих показания к дентальной имплантации, позволяющих индивидуально восстановить объем костной ткани и создающих благоприятные условия для интеграции дентального имплантата, обеспечивающих правильное проведение остеотомии костного ложа дентального имплантата без дополнительного изготовления хирургического шаблона для достижения высоких анатомо-функциональных и эстетических результатов реконструктивного лечения [25, 26].
Цель работы — расширение показаний к дентальной имплантации при выраженной атрофии костной ткани челюстей путем применения индивидуальных реконструктивных имплантатов из лиофилизированного аллогенного материала.
Материалы и методы
Обследование, планирование и лечение пациентов с выраженной атрофией костной ткани в области дефектов зубных рядов челюстей проводили с помощью общеклинических и специальных методов исследования (конусно-лучевой компьютерной томографии (КТ), денситометрии костной ткани челюстей, периотестметрии; реопародонтографии; изучения качества жизни). Хирургический этап состоял в проведении дентальной имплантации с одномоментной цифровой реконструкцией альвеолярной кости по авторскому способу (патент РФ на изобретение № 2624164) с применением индивидуальных реконструктивных имплантатов из лиофилизированного аллогенного материала (патент РФ на полезную модель № 177734). Последующее протезирование на имплантатах проводили по традиционной методике.
Клинический пример. Пациент А., 52 года, обратился с жалобами на отсутствие зубов, невозможность полноценного приема пищи.
Объективно: в полости рта отсутствуют зубы 2.6; 3.6, в области отсутствующего зуба 2.6 определяется значительная атрофия альвеолярного отростка верхней челюсти. Альвеолярная кость при пальпации широкая, со сниженной высотой. В области отсутствующего зуба 3.6 вертикальная и горизонтальная атрофия альвеолярного отростка нижней челюсти не определяется (рис. 1).
При анализе КТ на верхней челюсти выявлена значительно выраженная горизонтальная атрофия альвеолярного отростка слева, соответствующая уровню С (по Misch С.Е. и Judi K.W.M.), протяженность костного дефекта альвеолярного отростка верхней челюсти справа составила 12,3 мм, ширина альвеолярной кости варьировала от 8,3 до
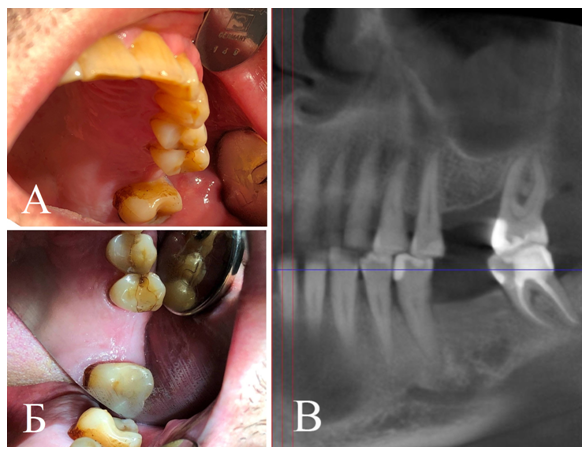
Рис. 1. Исходная клиническая ситуация в полости рта (А, Б) и сегмент панорамного среза компьютерной томограммы челюстей
Fig. 1. The initial clinical situation in an oral cavity (A, Б) and a segment of a panoramic cut of the computer tomogram of jaws of the patient A., 52 years
На основании клинико-рентгенологического обследования поставлен диагноз «частичное отсутствие зубов верхней челюсти, 3 класс по Кеннеди, осложненное атрофией альвеолярной кости; частичное отсутствие зубов нижней челюсти, 3 класс по Кеннеди; потеря жевательной эффективности по Агапову 12 %; этиологический фактор — кариес и его осложнения».
По компьютерной томограмме челюстей в программном обеспечении Planmeca Romexis Viewer проведено предварительное планирование: 3D-позиционирование дентальных имплантатов с учетом анатомо-топографических особенностей и протетической плоскости, определение дефицита параметров альвеолярной кости верхней челюсти справа, составление технического задания для моделирования формы и объема (с учетом последующей резорбции) и изготовления индивидуального реконструктивного имплантата из лиофилизированного аллогенного материала. Дефицит параметров альвеолярной кости верхней челюсти слева в проекции имплантата 3.6 по высоте — до
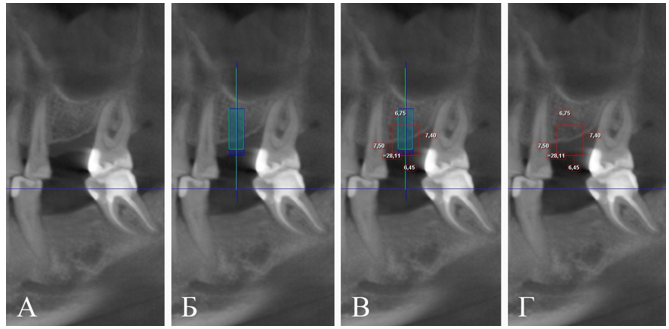
Рис. 2. Срез компьютерной томограммы челюстей:
А — исходная ситуация; Б — позиционирование имплантатов с учетом анатомо-топографических особенностей и протетической плоскости; В — позиционирование имплантатов с учетом последующей резорбции, реконструктивного костного имплантата; Г — техническое задание для изготовления индивидуального реконструктивного костного имплантата
Fig. 2. A cut of the computer tomogram of jaws of the patient К., 53 g:
A — an initial situation; Б — positioning of implants taking into account anatomo-topographical features and the protetichesky plane; В — positioning of implants taking into account the subsequent resorption; reconstructive bone implant; Г — the specification for production of an individual reconstructive bone implant
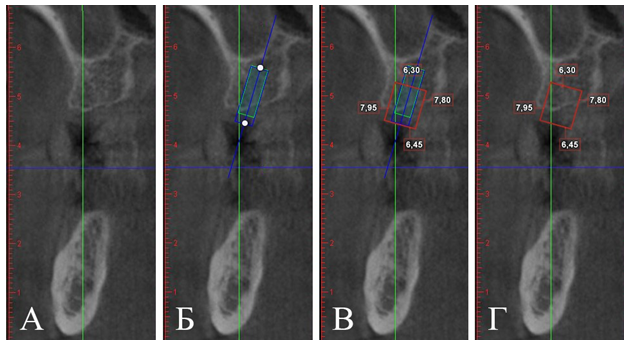
Рис. 3. Срез компьютерной томограммы челюстей в проекции 2.6:
А — исходная ситуация; Б — позиционирование имплантатов с учетом анатомо-топографических особенностей и протетической плоскости; В — позиционирование имплантатов с учетом последующей резорбции, реконструктивного костного имплантата; Г — техническое задание для изготовления индивидуального реконструктивного костного имплантата
Fig. 3. A cut of the computer tomogram of jaws in a projection 2.6:
A — an initial situation; Б — positioning of implants taking into account anatomo-topographical features and the protetichesky plane; В — positioning of implants taking into account the subsequent resorption; reconstructive bone implant;
Г — the specification for production of an individual reconstructive bone implant
Полученные цифровые данные компьютерной томографии челюстей при помощи алгоритма конвертации трансформировали в 3D-цифровую модель костного фрагмента челюстей в формате STL (рис. 4).
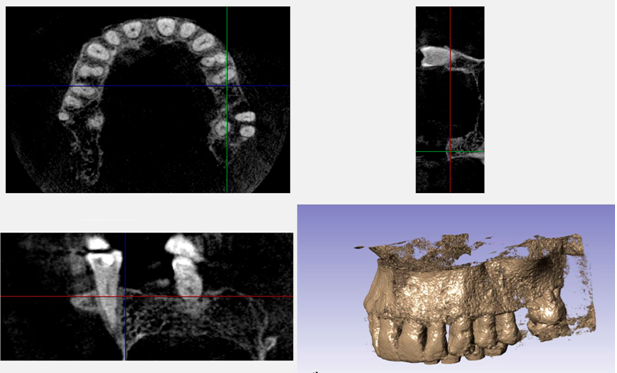
Рис. 4. Этап получения костного имплантата с индивидуальными параметрами, импорт цифровых данных компьютерной томографии челюстей и получение
3D-цифровой модели костного фрагмента челюстей
Fig. 4. Stage of receiving bone implant with individual parameters, import of figures of a computer tomography of jaws and receiving 3D-digital model of a bone fragment of jaws
В результате моделирования реконструктивного костного имплантата на основе индивидуального технического задания (рис. 5А) получили его цифровую твердотельную 3D-модель с индивидуальными параметрами. После фрезерной обработки с применением управляющей программы для изготовления костных блоков (рис. 5Б), разработанной авторами (свидетельство РФ о регистрации программ ЭВМ № 2015661930), из предварительно лиофилизированного аллогенного костного биоматериала получили реконструктивный имплантат с индивидуальными параметрами (рис. 5В).
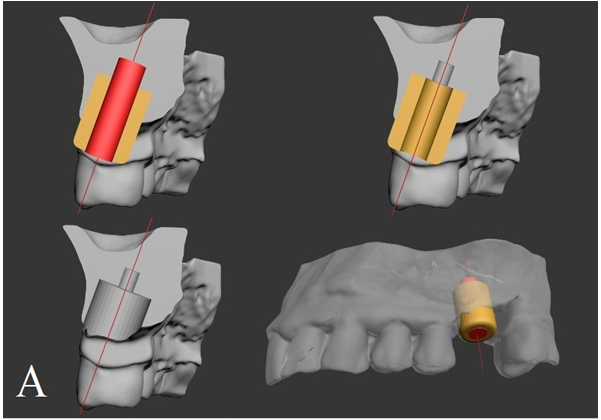
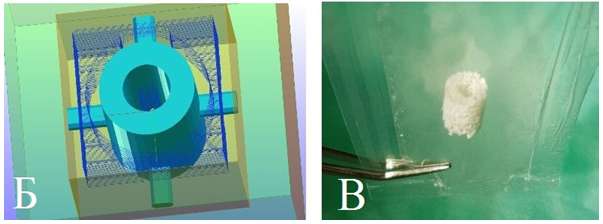
Рис. 5. Этапы получения костного имплантата с индивидуальными параметрами:
А — моделирование реконструктивного костного имплантата и направляющих дентальных имплантатов с учетом индивидуальных анатомо-топографических особенностей; Б — цифровая твердотельная 3D-модель реконструктивного костного имплантата в пространстве управляющей программы для изготовления костных блоков;
В — реконструктивный имплантат из лиофилизированного аллогенного материала с индивидуальными параметрами
Fig. 5. Stages of receiving bone implant with individual parameters:
A — modeling of a reconstructive bone implant and the implants directing the dentalnykh, taking into account specific anatomo-topographical features; Б — a digital solid-state 3D-model of a reconstructive bone implant in space of the operating program for production of bone blocks; В — a reconstructive implant from the lyophilized allogenny material with individual parameters
За 12 часов до операции пациенту была назначена превентивная антибактериальная терапия: амоксиклав 625 мг 3 раза в сутки. Под инфильтрационной анестезией Sol. Ultracaini D.S. — 1,7 ml делали разрез слизистой оболочки, отслаивание и откидывание слизисто-надкостничного лоскута. По предварительно подготовленному хирургическому имплантологическому шаблону проводили пилотное сверление, задавая направление и глубину погружения костного имплантата. Обрабатывали последовательно с помощью набора цилиндрических фрез различного диаметра полость в альвеолярном отростке верхней челюсти. До установки реконструктивный имплантат из лиофилизированного аллогенного материала с индивидуальными параметрами регидратировали и насыщали ультразвуком в течение одной минуты комплексом антибактериальных и противогрибковых препаратов (амоксиклав, бутол, дексаметазон, амфотерицин В), пропитывали компонентами крови из раны и вносили аутогенный компонент кости в его структуру (рис. 6). Устанавливали реконструктивный костный имплантат в обработанную полость альвеолярного отростка. Остеотомию костного ложа дентального имплантата проводили по предварительно смоделированной и отфрезерованной направляющей реконструктивного имплантата в глубь альвеолярного отростка челюсти на величину, равную ¼ длины внутрикостной части дентального имплантата от дна обработанной цилиндрической полости с учетом индивидуальных анатомо-топографических особенностей. Фиксацию реконструктивного костного имплантата осуществляли за счет адгезии к обработанным стенкам полости и за счет установленного дентального имплантата на ¼ длины его внутрикостной части в предварительно сформированное костное ложе на дне обработанной цилиндрической полости, устанавливали на внутрикостный дентальный имплантат формирователь десны. Мобилизовывали слизисто-надкостничный лоскут. Поверхность индивидуального реконструктивного имплантата из лиофилизированного аллогенного материала изолировали коллагеновой мембраной из твердой мозговой оболочки, насыщенной предварительно антибактериальным и противогрибковым компонентом (амоксиклав, бутол, дексаметазон, амфотерицин В), которую подшивали к надкостнице резорбируемой нитью Vicryl 5-0. Накладывали узловые швы нерезорбируемым шовным материалом Prolene 4-0 (рис. 7А—В).
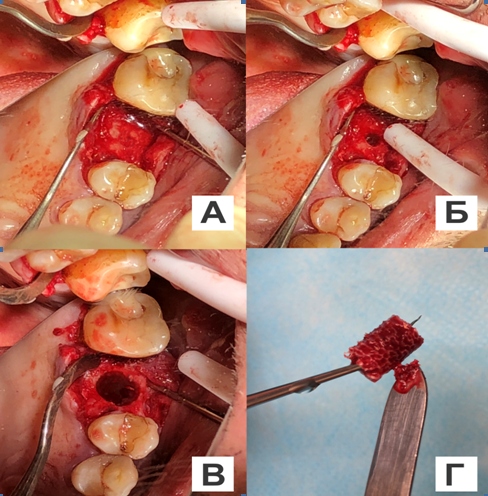
Рис. 6. Этапы оперативного вмешательства на верхней челюсти, слева:
А — отслаивание и откидывание слизисто-надкостничного лоскута; Б — пилотное сверление, выполненное по хирургическому имплантологическому шаблону, задает направление и глубину погружения костного имплантата; В — полость в альвеолярном отростке верхней челюсти; Г — внесение аутогенного компонента кости
Fig. 6. Surgery stages on the top jaw, at the left:
A — flaking and an otkidyvaniye mucous надкостничного a rag; Б — the pilot drilling executed on a surgical implantologichesky template sets the direction and depth of immersion of a bone implant; В — a cavity in an alveolar shoot of the top jaw; Г — introduction of an autogenic component of a bone
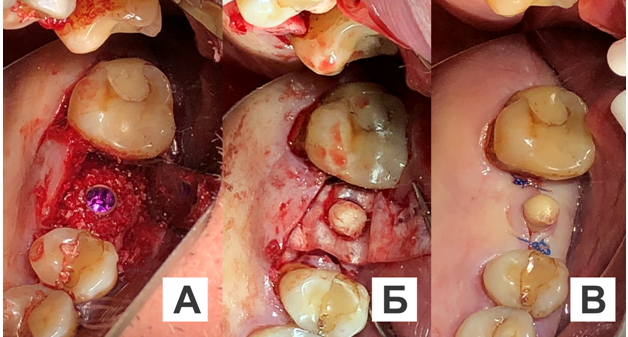
Рис. 7. Этапы оперативного вмешательства на верхней челюсти, слева:
А — фиксация реконструктивного костного имплантата за счет адгезии к обработанным стенкам полости и установленного дентального имплантата; Б — установлен формирователь десны на дентальный имплантат в области 2.6, поверхность индивидуального реконструктивного имплантата из лиофилизированного аллогенного материала изолирована коллагеновой мембраной из твердой мозговой оболочки; В — наложены узловые швы нерезорбируемым шовным материалом
Fig. 7. Surgery Stages on the top jaw, at the left:
A — fixing of a reconstructive bone implant due to adhesion to the processed walls of a cavity and the established dentalny implant, Б — is established the gum shaper on a dentalny implant in area 2.6 of an individual reconstructive implant from the lyophilized allogenny material isolated by a collagenic membrane from a firm brain cover; В — nodal seams are imposed by nerezorbiruyemy sutural material
Проводили комплексную терапию в послеоперационном периоде: общую и местную; противовоспалительную и симптоматическую, осложнений не отмечено. В течение 2 дней в области оперативного вмешательства наблюдали гиперемию слизистой оболочки и незначительную экссудацию. Коллатеральный отек полностью купирован на 6 сутки, швы были сняты на 12 сутки.
Показатели регионарного кровотока через 1 месяц после проведения дентальной имплантации с одномоментной костной пластикой указывали на развитие нарушений локальной гемодинамики. О начале развития процессов перестройки аллогенного костного блока свидетельствовало повышение изначальных показателей периферического сопротивления (ИПС) до 126,1 %, тонуса регионарных сосудов (ПТС) — до 26,4 % при одновременном снижении интенсивности кровотока (РИ) до 0,04 Ом и эластичности сосудистой стенки (ИЭ) до 48,5 %. Через 8 месяцев при анализе повторной компьютерной томограммы челюстей на панорамном срезе визуализируется новообразованная костная ткань. При сопоставлении срезов КТ исходной и после оперативного вмешательства отмечен прирост параметров альвеолярной кости в проекции 2.6 (по ширине — до
В области проведенной костной реконструкции анализ регионарного кровотока периимплантатных тканей через 8 месяцев показал снижение тонуса сосудов и уменьшение периферического сопротивления (преобладание вазодилататорных реакций), на что указывали снижение индексов ИПС (70,6 %) и ПТС (до 29,6 %), повышение ИЭ (до 80,9 %) и интенсивности регионарного кровоснабжения РИ (0,052 Ом).
Периотестометрия перед проведением ортопедического этапа лечения показала, что степень устойчивости дентального имплантата в проекции 2.6 — 2,52 у.е. Через 9 месяцев проведено ортопедическое лечение металлокерамической коронкой с опорой на дентальный имплантат 2.6.
Результаты анкетирования OHIP-14 на следующий день (24 балла) и через неделю (16 баллов) после фиксации несъемных ортопедических конструкций с опорой на дентальные имплантаты показали хороший уровень качества жизни пациента. Проведенным лечением пациент полностью удовлетворен.
Выводы
Применение индивидуальных реконструктивных имплантатов из лиофилизированного аллогенного материала при выраженной атрофии костной ткани челюстей позволяет значительно расширить показания к дентальной имплантации и сократить общую продолжительность лечения в среднем на 6 месяцев за счет одномоментного проведения аугментации и имплантации. Данные специальных методов исследования подтверждают, что вновь сформированная костная ткань полностью функциональна для принятия окклюзионной нагрузки на дентальный имплантат. Внедрение реконструктивного имплантата из лиофилизированного аллогенного материала приводит к увеличению площади контакта реконструктивного имплантата с аутогенной костной тканью альвеолы, увеличению его реваскуляризации и остеокондуктивного потенциала, снижению вероятности его отторжения и осложнений в постоперационном периоде, расширению показаний к дентальной имплантации.
1. Ломакин, М. В. Клинические испытания дентальных имплантатов в форме анализа и оценки клинических данных / М. В. Ломакин, Т. В. Омаров // Российская стоматология. - 2017. - № 10 (2). - С. 20-24.
2. Лукина, Ю. С. Получение индивидуальных 3d-имплантатов для костной пластики на основе кальциймагнийфосфатных материалов / Ю. С. Лукина, Н. В. Свентская, Д. В. Андреев // Международный научно-исследовательский журнал. - 2017. - № 04(58), Ч. 1. - С. 121-127.
3. Профилактика инфекционных осложнений при использовании кольцевидных костных аутотрансплантатов и дентальной имплантации / А. М. Панин, А. О. Зуева, Е. И. Чувилкина [и др.] // Российская стоматология. - 2016. - Т. 9, № 2. - С. 51-52.
4. Реконструкция объемных дефектов нижней челюсти с помощью имплантата-эндопротеза / С. В. Сирак, А. А. Слетов, А. В. Елизаров [и др.] // Медицинский вестник Северного Кавказа. - 2014. - Т. 9, № 1. - С. 87-91.
5. Jackson R.S., Price D.L., Arce K. et al. Evaluation of Clinical Outcomes of Osseointegrated Dental Implantation of Fibula Free Flaps for Mandibular Reconstruction. AMA Facial Plast Surg, 2016, vol. 18, no. 3, pp. 201-206.
6. Jensen A.T., Jensen S.S., Worsaae N. Complications related to bone augmentation procedures of localized defects in the alveolar ridge. A retrospective clinical study. Oral Maxillofac Surg, 2016, vol. 20 (2), pp. 115-122.
7. Krasny M., Krasny K., Fiedor P. et al. Long-term outcomes of the use of allogeneic, radiation-sterilised bone blocks in reconstruction of the atrophied alveolar ridge in the maxilla and mandible. 2015, vol. 16(4), pp. 631-638.
8. Le B.T., Borzabadi-Farahani A. Simultaneous implant placement and bone grafting with particulate mineralized allograft in sites with buccal wall defects, a three-year follow-up and review of literature, 2014, vol. 42(5), pp. 552-559.
9. Muraev A.A., Gazhva Y.V., Ivashkevich S.G. et al. A novel approach to alveolar bone complex defects 3D reconstruction. Sovremennye tehnologii v medicine, 2017, vol. 9(2), pp. 38-45.
10. Sakkas A., Wilde F., Heufelder M. et al. Autogenous bone grafts in oral implantology-is it still a "gold standard"? A consecutive review of 279 patients with 456 clinical procedures. Int. J. Implant Dent, 2017, vol. 3(1), pp. 23.
11. Salmen F.S., Oliveira M.R., Gabrielli M.A.C. et al. Bone grafting for alveolar ridge reconstruction. Review of 166 cases. Rev Col Bras Cir, 2017,vol. 44, no. 1, pp. 33-40.
12. Долгалев, А. А. Восстановление сложных по форме дефектов альвеолярного отростка верней челюсти / А. А. Долгалев, Е. М. Бойко // Российский вестник дентальной имплантологии. - 2014. - № 2(38). - С. 52-56.
13. Салеева, Г. Т. Результаты корреляционного анализа различных методов аугментации альвеолярных отделов челюстей / Г. Т. Салеева, П. Н. Михалев, Р. А. Салеев // Российский вестник дентальной имплантологии. - 2015. - № 1(31). - С. 65-68.
14. Современные подходы к применению метода дентальной имплантации при атрофии и дефектах костной ткани челюстей / А. А. Кулаков, Р. Ш. Гветадзе, Т. В. Брайловская [и др.] // Стоматология. - 2017. - № 1. - С. 43-45.
15. Khojasteh A., Behnia H., Shayesteh Y.S. et al. Localized bone augmentation with cortical bone blocks tented over different particulate bone substitutes: a retrospective study. Int. J. Oral Maxillofac Implants, 2012, vol. 27(6), pp. 1481-1493.
16. Zakhary I.E., El-Mekkawi H.A., Elsalanty M.E. Alveolar ridge augmentation for implant fixation: status review. Oral Surgery, Oral Medicine, Oral Pathology and Oral Radiology, 2012, vol. 114(5), pp. 179-189.
17. Cordaro L., Terheyden H. Ridge augmentation procedures in implant patients. A staged approach. Berlin, Quintessence Publishing (IL), 2014, 215 р.
18. Monje A., Pikos M.A., Chan H.L. et al. On the feasibility of utilizing allogeneic bone blocks for atrophic maxillary augmentation. Biomed Res Int., 2014, pp. 1-12.
19. Wang Y.-F., Wang C.-Y., Wan P. et al. Comparison of bone regeneration in alveolar bone of dogs on mineralized collagen grafts with two composition ratios of nano-hydroxyapatite and collagen. Regenerative Biomaterials, 2016, vol. 3, no. 1, pp. 33-40.
20. Altiparmak N., Akdeniz S.S., Bayram B. et al. Alveolar ridge splitting versus autogenous onlay bone grafting. Complications and implant survival rates. Implant Dentistry, 2017, vol. 26, no. 2, pp. 284-287.
21. Elnayef B., Monje A., Gargallo-Albiol J. et al. Vertical Ridge Augmentatiom in the Atrophic Mandible: A systematic review and meta-analysis. International Journal of Oral and Maxillofacial Implants, 2017, vol. 32, no. 2, pp. 291-312.
22. Кирилова, И. А. Костная ткань как основа остеопластических материалов для восстановления костной структуры / И. А. Кирилова // Хирургия позвоночника. - 2011. - № 1. - С. 68-74.
23. Jacotti M., Wang H.L., Fu J.H. et al. Ridge augmentation with mineralized block allografts: clinical and histological evaluation of 8 cases treated with the 3-dimensional block technique. Implant Dent, 2012, vol. 21(6), pp. 444-448. doi:https://doi.org/10.1097/ID.0b013e31826f7a67.
24. Rommer N., Kesting M.R., Rohleder N.H. et al. Mandible reconstruction with free fibula flaps: Outcome of a cost-effective individual planning concept compared with virtual surgical planning. Journal of CranioMaxillofacial Surgery, 2017, vol. 45(8), pp. 1246-1250. doi:https://doi.org/10.1016/j.jcms.2017.04.010.
25. Blume O., Hoffmann L., Donkiewicz P. et al. Treatment of Severely Resorbed Maxilla Due to Peri-Implantitis by Guided Bone Regeneration Using a Customized Allogenic Bone Block: A Case Report. Materials (Basel), 2017, vol. 10(10), pp. 1213. doi:https://doi.org/10.3390/ma10101213.
26. Santagata M., Sgaramella N., Ferrieri I. et al. Segmental sandwich osteotomy and tunnel technique for threedimensional reconstruction of the jaw atrophy: a case report. International Journal of Implant Dentistry, 2017, vol. 3, no. 1, pp. 14. doi:https://doi.org/10.1186/s40729-017-0077-3.



















